
【题目】下列离子方程式,正确的是( )
A.氢氧化铁与盐酸反应:H++OH-=H2O
B.铁与盐酸反应:2Fe+6H+=2Fe3++3H2↑
C.用小苏打治疗胃酸(盐酸)过多:HCO3-+H+=CO2↑+H2O
D.CaCO3溶于稀硝酸中:CO32-+2H+=CO2↑+H2O
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】过碳酸钠(![]() )在生产和生活领域应用广泛,其制备反应为:
)在生产和生活领域应用广泛,其制备反应为:![]()
![]() 。过碳酸钠具有Na2CO3和H2O2的双重性质, 在500C时分解为碳酸钠和过氧化氢。下列有关说法错误的是
。过碳酸钠具有Na2CO3和H2O2的双重性质, 在500C时分解为碳酸钠和过氧化氢。下列有关说法错误的是
A. 实验室制备过碳酸钠时可釆用冷水浴控制反应温度
B. 过碳酸钠水溶液呈碱性,可用作漂洗剂和消毒杀菌剂
C. 过碳酸钠应密封保存,放置于冷暗处
D. 过碳酸钠可使酸性高锰酸钾溶液褪色,并放出一种无色气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学中有许多的“守恒或相等“下列说法不正确的是
A. 化学反应中,反应物总能量与生成物总能量
B. 溶液中,阳离子电荷总数与阴离中电荷总数
C. 溶液中,稀释前后溶质质量与稀释后溶质质量
D. 化学反应中,参加反应物总质量与生成物总质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将一定量的冰醋酸加水稀释,稀释过程中溶液的导电性变化如图所示。则下列说法错误的是
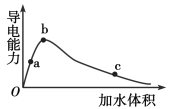
A.醋酸的电离程度:a<b<c
B.溶液的pH值:b>a>c
C.蘸取c点溶液滴在湿润的pH试纸上,测得pH值一定偏大
D.若分别向a、b、c三点的溶液中,加入同浓度的氢氧化钠溶液中和,消耗NaOH溶液的体积a=b=c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,盐桥中装有饱和溶液。下列说法正确的是( )
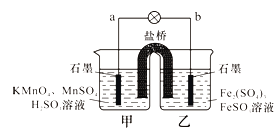
A.b电极上发生还原反应
B.外电路电子的流向是从a到b
C.电池工作时,盐桥中的SO42-移向甲烧杯
D.a电极上发生的反应为:MnO4-+8H++5e-=Mn2++4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红矾钠(重铬酸钠:![]() )是重要的基本化工原料,应用十分广泛。工业制备红矾钠的流程如下:
)是重要的基本化工原料,应用十分广泛。工业制备红矾钠的流程如下:
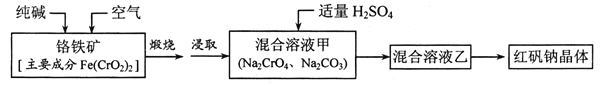
请回答下列问题:
(1)![]() 的基态电子排布式为____________。
的基态电子排布式为____________。
(2)锻烧铬铁矿发生反应:____________![]() 配平上述化学反应方程式。
配平上述化学反应方程式。
(3)溶液甲中加入H2SO4时,可以观察到溶液由黄色变为橙色,并放出无色气体,有 关反应的离子方程式为____________。
(4)制备红矾钠的废水必须进行处理。首先酸化废水,将含+6价铬的酸性废液放入电解槽内,用铁作阳极进行电解,阴极析出H2,阳极产物被![]() 氧化然后转化为Cr(OH)3、 Fe(0H)3 沉淀。
氧化然后转化为Cr(OH)3、 Fe(0H)3 沉淀。
①阳极的电极反应式为(不考虑后续反应):____________。
②溶液中金属离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因:______。
③已知某含![]() 的酸性废水中Cr元素的含量是52.5mg/L,处理后Cr元素最高允许 排量为0.5 mg/L。要处理100 m3废水达到排放标准,至少消耗铁_____kg。
的酸性废水中Cr元素的含量是52.5mg/L,处理后Cr元素最高允许 排量为0.5 mg/L。要处理100 m3废水达到排放标准,至少消耗铁_____kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题。
(1)CO可用于合成甲醇。在体积可变的密闭容器中充入4molCO和8molH2,在催化剂作用下合成甲醇:CO(g)+2H2(g)![]() CH3OH(g)(Ⅰ),平衡时CO的转化率与温度、压强的关系如下图所示:
CH3OH(g)(Ⅰ),平衡时CO的转化率与温度、压强的关系如下图所示:

①该反应的逆反应属于________反应;(填“吸热”或“放热”)。
②在0.1Mpa 、100℃的条件下,该反应达到平衡时容器体积为开始容器体积的_________倍。(结果保留两位小数点)
③在温度和容积不变的情况下,再向平衡体系中充入4molCO,达到平衡时CO转化率________(填“增大”,“不变”或“减小”),平衡常数K________(填“增大”,“不变”或“减小”)。
(2)在反应(Ⅰ)中需要用到H2做反应物,以甲烷为原料制取氢气是工业上常用的制氢方法。已知:
①CH4(g)+ H2O(g)= CO(g)+3H2(g) △H=+206.2 kJ·mol-1
②CH4(g)+ CO2(g)= 2CO(g)+2H2(g) △H=+247.4 kJ·mol-1
则CH4和H2O(g)反应生成CO2和H2的热化学方程式为: 。
(3)在反应(Ⅰ)中制得的CH3OH 即可以做燃料,还可以与氧气组成碱性燃料电池,电解质溶液是20%~30%的KOH溶液。则该燃料电池放电时:负极的电极反应式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于原电池的叙述中,正确的是( )
A.原电池负极发生的电极反应是还原反应
B.原电池是将化学能转化为电能的装置
C.原电池在工作时其正极不断产生电子经外电路流向负极
D.原电池的电极只能由两种不同的金属构成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于催化剂的说法正确的是
A. 使用催化剂可以增大正反应速率,减小逆反应速率
B. 使用催化剂可以使化学平衡正向移动
C. 使用催化剂可以降低反应的活化能
D. 使用催化剂可以改变反应的平衡常数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com