
短周期主族元素A、B、C、D的原子序数依次增大。已知A、C的原子序数之差为8,A、B、C三种元素原子的最外层电子数之和为15,B元素原子的最外层电子数等于A元素原子的最外层电子数的一半,下列叙述正确的是
A. 简单离子的半径:B>C>D>A
B. 氢化物的稳定性:C>D
C. A与C形成的化合物溶于水所得溶液显碱性
D. B与D形成的化合物溶于水所得溶液显酸性
科目:高中化学 来源:2016-2017学年黑龙江省高二上开学测化学卷(解析版) 题型:推断题
已知A是石油裂解产生的一种气态烃,完全燃烧时产生的水和二氧化碳的物质的量之比为1:1。B和D是生活中常见的两种有机物。它们之间的相互转化关系如图所示。(反应条件未写出)
又知2CH3CHO+O2 2CH3COOH。请回答下列问题;
2CH3COOH。请回答下列问题;
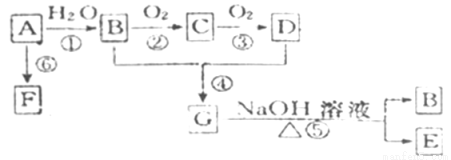
(1)写出A的电子式 。
(2)B、D分子内含有的官能团分别是 、 (填名称)。
(3)写出下列反应的反应类型:② ④ 。
(4)写出下列反应的化学方程式:
① ;② ;④ ;⑤ 。
(5)燃烧92g的乙醇需要标准状况下的氧气体积为 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高一上9.4周考化学试卷(解析版) 题型:选择题
2010年诺贝尔化学奖授予美日科学家,他们由于研究“有机物合成过程中把催化交叉偶联”而获奖。钯的化合物氯化钯可用来检测有毒气体CO,发生反应的化学方程式为:CO+PdCl2+H2O= CO2+Pd↓+2HCl。下列说法正确的是
A.题述反应条件下还原性:CO>Pd
B.题述反应中PdCl2被氧化
C.生成22.4LCO2时,转移的电子为2mol
D.CO气体只有在高温下才能表现还原性
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高一上9.4周考化学试卷(解析版) 题型:选择题
下列过程属于固氮的是( )
A.NH3→NO B.NO→NO2 C.N2→NO D.N2→NH3
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上第五次周练化学试卷(解析版) 题型:实验题
Ⅰ.现有含CaO杂质的CaC2试样。设计以下实验,测定CaC2试样的纯度。(反应方程式为:CaC2+2H2O→Ca(OH)2+C2H2↑),请从下图中选用适当的装置,完成该实验。

(1)制取C2H2最好选④中的_________装置(填“甲”“乙”或“丙”),所选用装置的连接顺序是_________________。(填各接口A~E的顺序)
(2)若实验时称取的试样为1.4 g,产生的乙炔在标准状况下的体积为448 mL,此试样中CaC2的质量分数为____________。(保留3位有效数字)
Ⅱ.某同学在实验室从如图标签的试剂瓶中取少许钠进行燃烧实验,实验后发现还有少许黑色固体生成。从反应物及实验操作猜测:

该黑色物质可能为炭与另一种氧化物组成的混合物。根据题意和图示回答下面问题:
(1)装置图⑤中A的名称_______________。
(2)此氧化物可能是___________或___________(写化学式)。
(3)对黑色固体物质的组成作如图⑥所示探究

①实验I加入盐酸溶液的目的是________________。
②仅通过实验Ⅱ,用最简步骤能快速确定黑色氧化物的组成,请完善该设计。(限选试剂:稀盐酸、KSCN溶液、10%H2O2溶液)

查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上第三次周练化学试卷(解析版) 题型:实验题
某学生对Na2SO3与AgNO3在不同pH下的反应进行探究。
(1)测得Na2SO3溶液pH=11,AgNO3溶液pH=5,二者水解的离子分别是 。
(2)调节pH,实验记录如下:
实验 | pH | 现象 |
A | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
B | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
C | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
查阅资料得知:
Ⅰ.Ag2SO3:白色,难溶于水,溶于过量Na2SO3的溶液
Ⅱ.Ag2O:棕黑色,不溶于水,能和酸反应
①推测a中白色沉淀为Ag2SO3,离子方程式是 。
②推测a中白色沉淀为Ag2SO4,推测的依据是 。
(3)取b、c中白色沉淀,置于Na2SO3溶液中,沉淀溶解。该同学设计实验确认了白色沉淀不是Ag2SO4,实验方法是:另取Ag2SO4固体置于 溶液中,未溶解。
(4)将c中X滤出、洗净,为确认其组成,实验如下:
Ⅰ.向X中滴加稀盐酸,无明显变化
Ⅱ.向X中加入过量浓HNO3,产生红棕色气体
Ⅲ.用Ba(NO3)2溶液、BaCl2溶液检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀
①实验Ⅰ的目的是 。
②根据实验现象,分析X的性质和元素组成是 。
③Ⅱ中反应的化学方程式是 。
(5)该同学综合以上实验,分析产生X的原因,认为随着酸性的增强,还原性增强。通过进一步实验确认了这种可能性,实验如图所示:

①气体Y是 。
②白色沉淀转化为X的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上第三次周练化学试卷(解析版) 题型:选择题
下列化学事实及其解释都正确的是
A.滴有酚酞的碳酸氢钠溶液显红色,微热后红色加深,是因为碳酸氢钠分解生成了碳酸钠
B.用洁净的玻璃管向包有过氧化钠的脱脂棉吹气,脱脂棉燃烧,说明二氧化碳、水与过氧化钠的反应是放热反应
C.向溴水中滴入植物油,振荡后油层显无色,说明溴不溶于油脂
D.粗锌与稀硫酸反应制氢气比纯锌快,是因为粗锌比纯锌还原性强
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高二上第二次月考化学试卷(解析版) 题型:实验题
Na2SO3应用广泛。利用工业废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO3的成本低,优势明显,其流程如下。
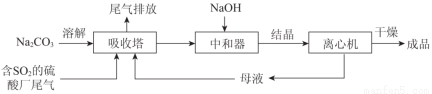
(1)举例说明向大气中排放SO2导致的环境问题:_________。
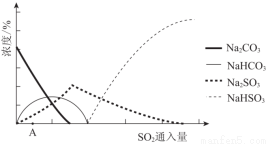
(2)下图为吸收塔中Na2CO3溶液与SO2反应过程中溶液组成变化。则初期反应(图中A点以前)的离子方程式是_________。
(3)中和器中发生的主要反应的化学方程式是_________。
资料显示: Ⅰ.Na2SO3在33℃时溶解度最大,将其饱和溶液加热至33℃以上时,由于溶解度降低会析出无水Na2SO3,冷却至33℃以下时析出Na2SO3·7H2O; Ⅱ.无水Na2SO3在空气中不易被氧化,Na2SO3·7H2O在空气中易被氧化。 |
(4)为了降低由中和器所得溶液中Na2SO3的溶解度,从而提高结晶产率,中和器中加入的NaOH是过量的。
①请结合Na2SO3的溶解平衡解释NaOH过量的原因_________。
②结晶时应选择的最佳操作是_________(选填字母)。
A.95~100℃加热蒸发,直至蒸干
B.维持95~100℃蒸发浓缩至有大量晶体析出
C.95 ~100℃加热浓缩,冷却至室温结晶
~100℃加热浓缩,冷却至室温结晶
(5)为检验Na2SO3成品中是否含少量Na2SO4,需选用的试剂是_________、_________。
(6)KIO3滴定法可测定成品中Na2SO3的含量:室温下将0.1260g 成品溶于水并加入淀粉做指示剂,再用酸性KIO3标准溶液(x mol/L)进行滴定至溶液恰好由无色变为蓝色,消耗KIO3标准溶液体积为y mL。
①滴定终点前反应的离子方程式是: IO3-+
IO3-+ SO32- =
SO32- = _______ +
_______ + _______(将方程式补充完整)。
_______(将方程式补充完整)。
②成品中Na2SO3(M = 126 g/mol)的质量分数是_________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上第二次月考化学试卷(解析版) 题型:选择题
下列有关几种试纸使用的描述中,不正确的是( )
A. 用湿润的红色石蕊试纸检验某种气体是否是NH3
B. 某种有色溶液可使淀粉-KI试纸变蓝色,则该溶液中可能含有Fe3+
C. 用玻璃棒蘸取溶液点在用蒸馏水湿润过的pH试纸上可测量该溶液的pH
D. 将湿润的蓝色石蕊试纸片粘在玻璃棒上置于氯气中,试纸先变红后褪色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com