
298 Kʱ��ij�ݻ��̶�Ϊ1 L���ܱ������з������¿��淴Ӧ��A(g) 2B(g)����H��-a kJ��mol��1������B�����ʵ���Ũ����ʱ��仯��ͼ��ʾ��
2B(g)����H��-a kJ��mol��1������B�����ʵ���Ũ����ʱ��仯��ͼ��ʾ��
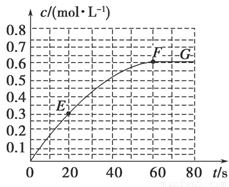
�Իش��������⡣
��1����֪298 Kʱ60 s�ﵽƽ�⣬�Ƚ�40��60 s�ں�60��80s��B��ƽ����Ӧ����:v(40��60) v(60��80)(�������������)��
��2����298 K�ﵽƽ��ʱ��B��ƽ��Ũ��ΪA��3�������ų�����x kJ����ʼ����A�����ʵ����� mol��
��3��298kʱ���÷�Ӧ��ƽ�ⳣ��Ϊ mol/L��
��4������Ӧ��298 K���У���1 L�ܱ������м���1 mol B��0.2 mol Ne���ﵽƽ��ʱ����������y kJ����ʱB��ת����Ϊ (�����)��
A������60% B������40%
C��С��40% D������40%��60%֮��
��5����ϣ�2������4��������ݣ�д��a��x��y���ߵĵ�ʽ��ϵʽ�� ��
��6������Ӧ��298K���У���Ӧ��ʼŨ��Ϊc(A)=c(B)=1.0mol/L����ѧƽ�⽫ (�����������)�ƶ���
��7����֪��������������֮�����ߵ�б�ʱ�ʾ��ʱ�����B��ƽ����Ӧ����(����ֱ��EF��б�ʱ�ʾ20 s��60 s��B��ƽ����Ӧ����)��������������һ�������б�ʵ������� ��
��1���� ��2��0.5 ��3��1.8 ��4��B ��5��a=2x+2y ��6������
��7��ijһʱ�̵ķ�Ӧ����(��ʱ���ʡ�˲ʱ����)��
��������
�����������1��40��60 s��B��Ũ����0.53mol��L-1��Ϊ0.6mol��L-1��60��80s��B��Ũ�Ȳ��ٱ仯����v(40��60) ��v(60��80)��
��2��ƽ��Ũ��c(B)=3c(A)= 0.6mol��L-1��1L�У��ɷ�Ӧ����Ӧ����0.6mol Bת��Ϊ0.3mol A����ʼ����A�����ʵ�����0.50mol��
��3��298kʱ���÷�Ӧ��ƽ�ⳣ��K= =
=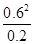 =1.8mol/L��
=1.8mol/L��
��4��ԭ��Ӧ����ʼʱ��c(A)=0.5��ƽ��ʱת��0.3 mol��L-1��ת����Ϊ60%����100%��ת���õ�1molB����1 L�ܱ������м���1 mol B��0.2 mol Ne����Ne�أ���ˣ�����ƽ���Ч����һ��ת����Ϊ40%��
��5����������4��������֪a=2x+2y��
��6��c(A)=c(B)=1.0mol/L��Qc=1.8mol/L��K����ѧƽ�������ƶ���
��7���������ɣ�����������һ�������б�ʵ������Ǹ�ʱ�̵ķ�Ӧ���ʡ�
���㣺��ѧ��Ӧ������ƽ����㡣


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��������ʡ��ʦ����2011��2012ѧ��߶���ѧ�����п��Ի�ѧ���� ���ͣ�022
| |||||||||||||||||||||||||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A.Q2=![]() B.Q2��
B.Q2��![]() C.Q2��Q1��197 kJ D.Q1=Q2=197 kJ
C.Q2��Q1��197 kJ D.Q1=Q2=197 kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A.![]() B.Q2��
B.Q2��![]() C.
C. ![]() ��Q2��Q1 D.Q1=Q2=197 kJ
��Q2��Q1 D.Q1=Q2=197 kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��ר���� ���ͣ������
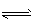 2B(g) ��H=a kJ . mol-1������B�����ʵ���Ũ����ʱ��仯��ͼ��ʾ��
2B(g) ��H=a kJ . mol-1������B�����ʵ���Ũ����ʱ��仯��ͼ��ʾ�� 
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com