
| A. | 发生化学反应时失去电子越多的金属原子,还原能力越强 | |
| B. | NaCl只有在水溶液中才能电离出Na+、Cl- | |
| C. | 能与酸反应的氧化物,不一定是碱性氧化物 | |
| D. | 电离时能产生H+的化合物是酸 |
分析 A.金属的还原性强弱与失电子难易程度有关,与失电子多少无关;
B.氯化钠在熔融状态下或水溶液里能电离出阴阳离子;
C.能与酸反应的氧化物也可能是两性氧化物;
D.电离时能生成氢离子的化合物也可能是盐.
解答 解:A.金属的还原性强弱与失电子难易程度有关,与失电子多少无关,如:相同物质的量的Al、Na分别和足量稀盐酸反应,Al失电子比Na多,但金属性Na>Al,故A错误;
B.氯化钠在熔融状态下或水溶液里能电离出Na+、Cl-,所以氯化钠发生电离不一定在水溶液里,故B错误;
C.能与酸反应的氧化物也可能是两性氧化物,如氢氧化铝,故C正确;
D.电离时能生成氢离子的化合物也可能是盐,如硫酸氢钠等,故D错误;
故选C.
点评 本题考查元素化合物性质、基本概念、金属性强弱判断等知识点,明确元素化合物性质是解本题关键,注意规律中的特殊现象,易错选项是A.


科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
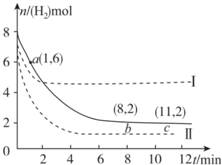
| A. | 若曲线I对应的条件改变是升高温度,则该反应△H>0 | |
| B. | 曲线II对应的条件改变是降低压强 | |
| C. | 反应开始至a点时v(H2)=1mol•L-1•min-1 | |
| D. | 保持温度不变,若将平衡后的容器体积缩小至1L,重新达平衡时则2 mol•L-1<c(CH3OH)<$\frac{8}{3}$mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用水鉴别乙醇和溴苯 | |
| B. | 用红外光谱鉴别丙醛和1-丙醇 | |
| C. | 用溴水鉴别苯和正庚烷 | |
| D. | 用核磁共振氢谱鉴别1-溴丙烷和2-溴丙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑦⑧ | B. | ①③⑤⑦⑧ | C. | ①③⑤⑧ | D. | ②④⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,18g重水(D2O)所含的中子数为10NA | |
| B. | 100℃时,1LpH=1的硫酸溶液中,含有0.2NA个H+ | |
| C. | 71g氯气发生氧化还原反应,一定失去2NA个电子 | |
| D. | 室温下,14gN2和CO的混合气体中含有的原子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫离子的结构示意图为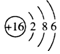 | |
| B. | 核外电子排布相同的微粒化学性质也相同 | |
| C. | 氢弹中用到的2H、3H互为同位素 | |
| D. | 同种元素的原子均有相同的质子数和中子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com