
����Ŀ��������Ԫ��X��Y��Z��Ԫ�����ڱ��е�λ����ͼ��ʾ������YԪ��ԭ�ӵ������������ǵ��Ӳ������������ش��������⣺
X | ||
Y | Z |
��1��ZԪ����Ԫ�����ڱ��е�λ���� ��
��2��������֤��YԪ����ZԪ�صĵõ�������ǿ������ �� ������ţ�
A.�⻯��ˮ��Һ������
B.����������Ӧ��ˮ���������
C.��̬�⻯����ȶ���
D.���������ʱÿ��ԭ�ӵõ��ӵĶ���
��3���Ƚ�Y��Z�����Ӱ뾶��С�������ӷ��ű�ʾ��
��4��XԪ�ص�ij����̬�⻯������к���10�����ӣ��������ڼ����������ܹ���CuO��ԭΪCu��ͬʱ����һ�����壬�������ǿ����еijɷ�֮һ����Ӧ�Ļ�ѧ����ʽΪ �� ����Ӧ����6.02��1022�����ӷ���ת�ƣ�����g��CuO�μӷ�Ӧ��
���𰸡�
��1���������ڵ�VIA��
��2��BC
��3��S2����Cl��
��4��3CuO+2NH3 ![]() 3Cu+3H2O+N2��4
3Cu+3H2O+N2��4
���������⣺������Ԫ���У�YԪ��ԭ�ӵ������������ǵ��Ӳ�������������Ԫ�������ڱ��е�λ�ã���֪Xλ�����ڱ��ڶ����ڣ�Y��Zλ�����ڱ��������ڣ�YԪ��ԭ�ӵ�������������6����ӦΪSԪ�أ���֪ZΪCl��XΪNԪ�أ���1��YΪSԪ�أ�λ�����ڱ��������ڵ�VIA�壬���Դ��ǣ��������ڵ�VIA�壻��2���Ƚ�Ԫ�صķǽ�����ǿ�����ɸ�������������Ӧˮ��������ԡ���Ӧ���⻯����ȶ��ԡ�Ԫ�ص�����û��Ƚ����жϣ��⻯�����ԡ���õ��Ӷ��ٲ��ܱȽϷǽ���ǿ������ѡ��BC����3�����Ӳ�ṹ��ͬ�����ӣ��˵����Խ�����Ӱ뾶ԽС�����뾶��С��S2����Cl�� �� ���Դ��ǣ�S2����Cl������4��XԪ�ص�ij����̬�⻯������к���10�����ӣ�����⻯��ΪNH3 �� �������ڼ����������ܹ���CuO��ԭΪCu��ͬʱ����һ�����壬�������ǿ����еijɷ�֮һ�������ɵ�����Ϊ��������Ӧ����ʽΪ��3CuO+2NH3 ![]() 3Cu+3H2O+N2 �� ����Ӧ����6.02��1022�����ӷ���ת�ƣ���Ӧ��ת�Ƶ���0.1mol����������ͭΪ
3Cu+3H2O+N2 �� ����Ӧ����6.02��1022�����ӷ���ת�ƣ���Ӧ��ת�Ƶ���0.1mol����������ͭΪ ![]() =0.05mol���μӷ�ӦCuO��������0.05mol��80g/mol=4g�����Դ��ǣ�3CuO+2NH3
=0.05mol���μӷ�ӦCuO��������0.05mol��80g/mol=4g�����Դ��ǣ�3CuO+2NH3 ![]() 3Cu+3H2O+N2��4��
3Cu+3H2O+N2��4��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о�С������ͼװ��̽��SO2��Fe��NO3��3��Һ�ķ�Ӧ����֪��1.0molL��1��Fe��NO3��3��Һ��pH=1����ش��������⣺
��1���μ�Ũ����֮ǰ����ͨ������Ŀ���� �� Cװ�õ������� ��
��2����ַ�Ӧ����˵��SO2��Fe��NO3��3��Һ������Ӧ��ʵ�������� ��
��3��Ϊ̽��SO2��Fe��NO3��3��Һ������Ӧ��ԭ�������о�С��������²��룺����1��SO2��Fe3+��Ӧ��
����2��������������SO2��NO3����Ӧ��
����3��
��������1������װ��B�з�Ӧ�����ӷ���ʽ������Ҫ����Fe3+�Ƿ�ľ��������Լ��Ļ�ѧʽ�� ��
��������2������������ѡ�������Լ��е�������ĸ����SO2��Ӧ����һ����֤��
a��NaNO3��BaCl2�Ļ����Һ
b��FeCl3 �� NaNO3�Ļ����Һ
c��FeCl3��BaCl2�Ļ����Һ��
��4��SO2Ϊ������Ⱦ��о�С��Ϊ�ⶨij������������SO2�ĺ�����ȡ10m3����״���£�����������ͨ��������ˮ�У���������Һ�м��������BaCl2��Һ���������İ�ɫ����ϴ�ӡ�����Ƶ�����Ϊ0.4660g����˿�����SO2��Ũ��Ϊmgm��3 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ա�����ա����ػ������������ʱ�����봩��10ǧ���صIJ��ں�����������ߡ��Ա�������ں���������ҹ���ѧ�ҽ��������Ƶ����͡�������ά���͡����ղ������ɣ�����Ҫ�ɷ�����̼���衢�մɺ�̼��ά���϶��ɵģ�������������������(����)
A.�����¡�������
B.���ȸ����ᡢӲ�����ʵؽϴ�
C.��û�й̶��۵�
D.����һ���������ǽ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����40��ı�������ͭ��Һ������50��,�����¶��Ա�����40�������������ˮ����ͭ��������������¾����ֲ������
A.����ͭ���ܽ��B.��Һ�����ʵ���������
C.��Һ������D.��Һ��Cu2������Ŀ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڻ�ѧ����˵����ȷ���� ( )
A. ���ɵ��ʷ��ӵ���һ�����й��ۼ�
B. �ɷǽ���Ԫ����ɵĻ����ﲻһ���ǹ��ۻ�����
C. �Ǽ��Լ�ֻ������˫ԭ�ӷ�����
D. ��ͬԪ����ɵĶ�ԭ�ӷ�����Ļ�ѧ��һ���Ǽ��Լ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A.���ݷе��������ж�����Һ�������Ƿ�����������з���
B.���ݹ����ܽ�����߿����ж����ʽᾧ�ķ���
C.���ݡ�H�����жϻ�ѧ��Ӧ�ܷ��Է�����
D.���ݻ�ѧƽ�ⳣ�������жϻ�ѧ��Ӧ���е���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij�ϴ�ý[��Ҫ�ɷ�Ϊ����̿��ZnO��FeO����CH3COO��2Zn]����ȡ����п�����ʵ�鲽����ͼ��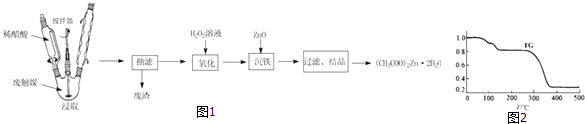
��1����ȡʱ����������ƿ�м���ϴ�ý��ϡ���ᣬ��������ƿ���Ȳ�ͬʱ������������Ŀ���� ��
��2�����Ƚ��ϴ�ý������¯��ͨ����500�洦��һ��ʱ�䣬�����ʻ�����ߣ���ԭ���� �� ����ʱ�õĹ��������������� ��
��3������ͼ�м���H2O2��Ŀ���� ��
��4�����þ��壨CH3COO��2Zn2H2O���ط�����TG/%=������Ʒ��ʣ������/������Ʒ����ʼ����������ͼ2�������ױ����ֽ�������Σ���200��C������ȥ�����ӽᾧˮ���γɵģ�CH3COO��2Zn��242��C���ڣ�370��C��ȫ�ֽ�ΪZnOͬʱ����CO2��һ�ֺ���������˴Ź�������ֻ��1��壩����CH3COO��2Zn�ֽ���������п�ķ�Ӧ����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ȷ���ǣ� ��
A.ͭ����������Һ��Ӧ��Cu+Ag+�TCu2++Ag
B.����ʯ�ܽ������CaCO3+2H+�TCa2++CO2��+H2O
C.��NaAlO2��Һ��ͨ��������CO2��AlO ![]() +CO2+2H2O�TAl��OH��3��+HCO
+CO2+2H2O�TAl��OH��3��+HCO ![]()
D.Fe��ϡHNO3��Ӧ��Fe+2H+�TFe2++H2��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com