
| A. | 只有① | B. | ①和② | C. | ①②③ | D. | ①②③④ |
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:填空题
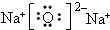 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A.NH3(g)+$\frac{5}{4}$O2(g)═NO(g)+$\frac{6}{4}$H2O(g);△H=-akJ•mol-1 | |
| B. | C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l);△H=-bkJ•mol-1 | |
| C. | 2CO(g)+O2(g)═2CO2(g);△H=-ckJ•mol-1 | |
| D. | CH3CH2OH(l)+$\frac{1}{2}$O2(g)═CH3CHO(l)+H2O(l);△H=-dkJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol甲苯含有6NA个C-H键 | |
| B. | 0.1 molCH2=CH-COOH中含有双键的数目为0.1NA | |
| C. | 标准状况下,11.2 L苯中含有分子的数目为0.5NA | |
| D. | 丙烯和乙烯组成的56 g混合气体中氢原子的个数为8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲醛 | B. | 乙醛 | C. | 甲酸 | D. | 乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
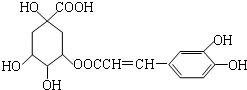
| A. | 分子式为C16H18O9 | |
| B. | 1mol咖啡鞣酸水解时可消耗8molNaOH | |
| C. | 咖啡鞣酸分子中所有原子都在同一平面上 | |
| D. | 与浓溴水既能发生取代反应又能发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
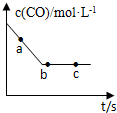 汽车排放的尾气为大气污染源之一,目前,可利用以下化学原理解决尾气:
汽车排放的尾气为大气污染源之一,目前,可利用以下化学原理解决尾气:| 实验编号 | 实验目的 | T/℃ | NO初始浓度 mol/L | CO初始浓度 mol/L | 同种催化剂的比表面积 m2/g | 达平衡时所用的时间min |
| Ⅰ | 参照实验 | 280 | 6.50×10-3 | 4.00×10-3 | 80 | t |
| Ⅱ | 280 | 6.50×10-3 | 4.00×10-3 | 120 | 0.5t | |
| Ⅲ | 探究温度对反应速率的影响 | 360 | 6.50×10-3 | 4.00×10-3 | 80 | 0.2t |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Fe2+、NO3-、H+ | B. | K+、Mg2+、I-、ClO- | ||
| C. | K+、Ba2+、Cl-、Br- | D. | K+、HCO3-、Cl-、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
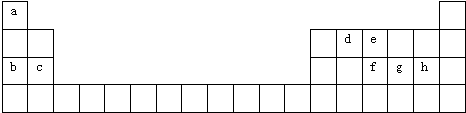
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com