
| A. | 定容时俯视刻度线 | |
| B. | 容量瓶中原有少量蒸馏水 | |
| C. | 定容时液面高于刻度,用滴管小心吸去多余溶液,使液面与刻度相切 | |
| D. | 称取Na2CO3固体时,采用了“左码右物” |
分析 分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析,凡是使溶质的物质的量n偏大或使溶液体积V偏小的操作,都会导致溶液浓度偏高,反正,溶液浓度偏低.
解答 解:A.定容时俯视刻度线,导致溶液体积偏小,依据C=$\frac{n}{V}$可知,溶液浓度偏高,故A选;
B.容量瓶中原有少量蒸馏水,对溶质的物质的量n和溶液体积V都不会产生影响,依据C=$\frac{n}{V}$可知,溶液浓度不变,故B不选;
C.定容时液面高于刻度,用滴管小心吸去多余溶液,使液面与刻度相切,导致部分溶质损耗,溶质的物质的量偏小,依据C=$\frac{n}{V}$可知,溶液浓度偏低,故C不选;
D.配制0.5mol•L-1Na2CO3溶液100mL,需要溶质的质量=0.5mol/L×106g/mol×0.1L=5.3g,依据托盘天平称量原理:左盘质量=右盘质量+游码质量,若“左码右物”则实际称量质量为5-0.3=4.7g,导致溶质的物质的量偏小,溶液浓度偏低,故D不选;
故选:A.
点评 本题考查了一定物质的量浓度溶液的配制过程中误差分析,准确把握操作对溶质的物质的量和溶液体积的影响是解题关键,题目难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 当a=5时,c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-) | |
| B. | 当a=10时,c(Cl-)+c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4) | |
| C. | 当a=15时,c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.04 mol•L-1 | |
| D. | 当a=20时,c(Na+)=c(H+)>c(HC2O4-)>c(C2O42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3是强电解质,BaCO3是弱电解质 | |
| B. | c(H+)=1×10-7mol•L-1的溶液一定呈中性 | |
| C. | 将硫酸铝和氯化铝溶液分别加热蒸干后灼烧,得到的固体都是氧化铝 | |
| D. | 将0.1 mol•L-1醋酸溶液加水稀释时,电离能力增强,但c(H+)变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
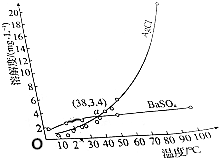
| A. | a点时,AgCl和BaSO4饱和溶液的密度基本相同 | |
| B. | AgCl的溶解是吸热过程 | |
| C. | 室温时,向等体积的饱和AgCl和BaSO4溶液中分别加入足量的浓BaCl2溶液,析出BaSO4沉淀的质量比AgCl多 | |
| D. | 可以用重结晶的方法分离AgCl和BaSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,含有离子键和非极性共价键的化合物的电子式为
,含有离子键和非极性共价键的化合物的电子式为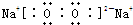 ;含有极性共价键和非极性共价键的化合物的电子式为
;含有极性共价键和非极性共价键的化合物的电子式为 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 甲苯无同分异构体 | |
| B. | 邻二甲苯只有一种 | |
| C. | 苯分子中各原子均在一个平面内,各键键角均为120° | |
| D. | 1mol苯最多只能与3mol H2加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体中不存在独立的“分子” | |
| B. | 含有1 mol C的金刚石中,形成的共价键有2 mol | |
| C. | 是自然界中硬度最大的物质 | |
| D. | 化学性质稳定,即使在高温下也不会与氧气发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10-3 | B. | 10-7 | C. | 10-11 | D. | 10-14 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高一上9月调研化学试卷(解析版) 题型:选择题
NA表示阿伏加德罗常数的值,下列叙述正确的是
A.44g CO2含有氧原子数为NA
B.物质的量浓度为0.5mol/L MgCl2溶液,含有Cl-离子数为NA
C.标准状况下,22.4L四氯化碳含有的分子数为NA
D.常温常压下,14g N2含有分子数为0.5NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com