
已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10mL浓度为0.1mo1·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中
A.水的电离程度始终增大
B.c(NH4+) / c (NH3·H2O)先增大再减小
C.c(CH3COOH)与c(CH3COO-)之和始终保持不变
D.当加入氨水的体积为10mL时,c(NH4+)=c(CH3COO-)
【知识点】酸碱混合时溶液定性判断H1 H2 H6
【答案解析】D 解析:A、向10mL浓度为0.1mo1·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中水的电离程度先增大,随着氨水浓度的增加水的电离被抑制,水的电离程度减小,故A错误;B、当向CH3COOH溶液中滴加相同浓度的氨水,开始时溶液为CH3COOH和CH3COONH4的混合物,由CH3COONH4的水解常数Kh=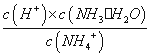 ,随着氨水的加入,c(H+)逐渐减小,Kh不变,c(NH4+) / c (NH3·H2O)变小,当加氨水至溶液显碱性时,氨水的电离常数
,随着氨水的加入,c(H+)逐渐减小,Kh不变,c(NH4+) / c (NH3·H2O)变小,当加氨水至溶液显碱性时,氨水的电离常数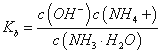 随着氨水的加入,c(OH-)逐渐增大,Kb不变,c(NH4+) / c (NH3·H2O)变小,所以c(NH4+) / c (NH3·H2O)始终减小,故B错误;C.n(CH3COOH)与n(CH3COO-)之和为0.001mol,始终保持不变,由于溶液体积逐渐增大,所以c(CH3COOH)与c(CH3COO-)之和逐渐减小,故C错误;
随着氨水的加入,c(OH-)逐渐增大,Kb不变,c(NH4+) / c (NH3·H2O)变小,所以c(NH4+) / c (NH3·H2O)始终减小,故B错误;C.n(CH3COOH)与n(CH3COO-)之和为0.001mol,始终保持不变,由于溶液体积逐渐增大,所以c(CH3COOH)与c(CH3COO-)之和逐渐减小,故C错误;
D.当加入氨水的体积为10mL时,醋酸和一水合氨的物质的量相等,由于二者的电离常数相等,所以溶液显示中性,c(H+)=c(OH-),根据电荷守恒可知:c(NH4+)=c(CH3COO-),故D正确;
故答案选D
【思路点拨】本题考查了酸碱混合时溶液定性判断及溶液酸碱性与溶液pH的关系,注意电荷守恒以及电离常数不随温度变化的灵活应用。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
下列叙述中正确的是( )
A.含氧酸起氧化作用,无氧酸则不能 B.还原剂在反应中得电子
C.还原剂在反应中发生氧化反应 D.氧化剂在同一反应中既可以是反应物,也可以是生成物
查看答案和解析>>
科目:高中化学 来源: 题型:
COCl2(g)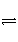
 CO(g)+Cl2(g) ΔH>0。当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是( )
CO(g)+Cl2(g) ΔH>0。当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是( )
A.①②④ B.①④⑥ C.②③⑤ D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中投入一定量的A和B发生反应:
mA(g)+nB(g)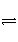
 pC(g)+qD(g)。
pC(g)+qD(g)。

(1)若开始时加入A物质m mol,欲使A与B的转化率相等,则加入B物质________mol。
(2)相同的压强下,充入一定量的A、B后,在不同温度下C的百分含量与时间的关系如图1所示。则T1(填“>”、“<”或“=”)______T2,该反应正反应方向的ΔH(填“>”、“<”或“=”)______0。
(3)一定条件下,从正反应开始至达到化学平衡的过程中,混合气体的平均相对分子质量随时间的变化如图2所示,测得达到平衡时A、B、C、D的物质的量均为1 mol。
①若在恒温、恒容的条件下,向该平衡体系中再通入A、B、C、D各1 mol,则体系中气体的平均相对分子质量(填“增大”、“减小”、“不变”或“无法确定”)__________。
②若恒温、恒压的条件下,向原平衡体系中再通入A、B、C、D各1 mol,则体系中气体的密度(填“增大”、“减小”、“不变”或“无法确定”)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列有关电解质溶液的叙述正确的是 ( )
A.等浓度等体积的强酸与强碱溶液混合后,溶液的pH=7
B.pH=2的盐酸与pH=12的氨水等体积混合后所得溶液显中性
C.pH=10的Ba(OH)2溶液和pH=13的NaOH溶液等体积混合后溶液的pH=10.7(已知lg 2=0.3)
D.将10 mL pH=a的盐酸与100 mL pH=b的Ba(OH)2溶液混合后恰好中和,则a+b=13
查看答案和解析>>
科目:高中化学 来源: 题型:
分类是学习和研究化学的一种常用的科学方法。下列分类合理的是
①根据酸分子中含有H原子个数将酸分为一元酸、二元酸等
②碱性氧化物一定是金属氧化物
③根据丁达尔现象可将分散系分为胶体、溶液和浊液
④SiO2是酸性氧化物,能与NaOH溶液反应
⑤根据反应的热效应将化学反应分为放热反应和吸热反应
A. ②③ B.②④⑤ C.①②④ D.②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.等物质的量浓度的硫酸氢铵溶液和氢氧化钠溶液等体积混合:
c(S042-)>c(Na+)>C(NH4+)>c(OH-)=c(H+)
B.常温下0.4mol/LHB溶液和0.2mol/LNaOH溶液等体积混合后溶液的pH=3,则溶液中微粒浓度存在下面关系: c(HB)>c(Na+)>c(B-)>c(H+)>c(OH-)
C.在滴有酚酞溶液的氨水中,加入NH4CI的溶液恰好无色,则此时溶液的PH<7
D.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,若混合液pH=7,则溶液中:2c(R2-)+c(HR-)=c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
能正确表示下列反应的离子方程式
A.向苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O―→2C6H5OH+CO32-
B.(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-=Fe(OH)2↓
C.向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2 + 2Fe3+ = 2Fe(OH)3 + 3Mg2+
D.NaHCO3溶液与稀H2SO4反应:CO32-+ 2H+ = H2O + CO2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com