
��ס��ҡ��������ܱ������г���һ������A��B��������Ӧ��A(g) + xB(g) 2C(g)���������ķ�Ӧ�¶ȡ���Ӧ����ʼ������Ӧ������C��Ũ����ʱ��仯��ϵ�ֱ����±�����ͼ��ʾ��
2C(g)���������ķ�Ӧ�¶ȡ���Ӧ����ʼ������Ӧ������C��Ũ����ʱ��仯��ϵ�ֱ����±�����ͼ��ʾ��
���� | �� | �� | �� |
�ݻ� | 0.5L | 0.5L | 1.0L |
�¶�/�� | T1 | T2 | T2 |
��Ӧ�� ��ʼ�� | 1.5molA 0.5molB | 1.5molA 0.5molB | 6.0molA 2.0molB |

����˵����ȷ����
A��10min�ڼ������з�Ӧ��ƽ������v(A)��0.025mol/(L��min)
B����ͼ��֪��T1��T2���Ҹ÷�ӦΪ���ȷ�Ӧ
C��x��1����ƽ��ʱ�����¶Ȳ��䣬�ı��������ƽ�ⲻ�ƶ�
D��T1�棬��ʼʱ�������г���0.5molA��1.5molB��ƽ��ʱA��ת����Ϊ25%
B��C
��������
���������A��10min�ڼ������з�Ӧ��ƽ������v(C)��1.25mol ��0. 5L��10min=0.125mol/(L��min)������v(C)��2v(A)������v(A)=0.0625mol/(L��min)������B�����ڼס���������Ӧ������ͬ������Ӧ�¶Ȳ�ͬ�������ȴﵽƽ�⣬˵����T1��T2�����������¶ȣ�C��ƽ�⺬����С��˵�������¶ȣ�ƽ�������ƶ�������ƽ���ƶ�ԭ����֪�������¶ȣ�ƽ�������ȷ�Ӧ�����ƶ����淴Ӧ���������ȷ�Ӧ�������Ҹ÷�ӦΪ���ȷ�Ӧ����ȷ��C��x��1����÷�Ӧ�Ƿ�Ӧǰ�����������ȵķ�Ӧ����ƽ��ʱ�����¶Ȳ��䣬�ı�������������ı������ѹǿ��ƽ�ⲻ�ƶ�����ȷ��D��T1�棬��ʼʱ�������г���1.5molA��0.5molB��ƽ��ʱC�ĵ����ʵ�����1. 5mol����Ӧ����A0.75mol��Aת����Ϊ50%,�������ʵ�����ͬʱ����ʼʱ�����ʵ�����Ϊ0.5molA��1.5molB�����൱��������B�ĺ�����ƽ�������ƶ���Aת����������50%,����
���㣺����ͼ���ڱ�ʾ��ѧƽ���ƶ�����Ӧ���ʡ����ʵ�ת���ʼ���Ӧ�ȵ��ж��е�Ӧ�õ�֪ʶ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�꽭��ʡ����������⻯ѧ�Ծ��������棩 ���ͣ������
��15�֣��о����������������ڴ����к������ӵ������ʱ���漰���·��ȷ�Ӧ��
2NO2��g��+NaCl��s�� NaNO3��s��+ClNO��g�� K1 ?H =a kJ/mol ��I��
NaNO3��s��+ClNO��g�� K1 ?H =a kJ/mol ��I��
2NO��g��+Cl2��g�� 2ClNO��g�� K2 ?H =b kJ/mol ��II��
2ClNO��g�� K2 ?H =b kJ/mol ��II��
��1����Ӧ4NO2��g��+2NaCl��s�� 2NaNO3��s��+2NO��g��+Cl2��g����ƽ�ⳣ��K= ����K1��K2��ʾ����?H= kJ/mol����a��b��ʾ����
2NaNO3��s��+2NO��g��+Cl2��g����ƽ�ⳣ��K= ����K1��K2��ʾ����?H= kJ/mol����a��b��ʾ����
��2��Ϊ�о���ͬ�����Է�Ӧ��II����Ӱ�죬�ں��������£���2L�����ܱ������м���0��2mol NO��0��1mol Cl2��10minʱ��Ӧ��II���ﵽƽ�⡣���10min��v��ClNO��=7��5��10-3mol?L-1?min-1����ƽ���
n��Cl2��= mol�������������ֲ��䣬��Ӧ��II���ں�ѹ�����½��У�ƽ�ⳣ��K2 ���������С�����䡱)��
��3��ʵ���ҿ���NaOH��Һ����NO2����ӦΪ2NO2+2NaOH=NaNO3+NaNO2+H2O����0��2mol NaOH��ˮ��Һ��0��2mol NO2ǡ����ȫ��Ӧ��1L��ҺA����ҺBΪ0��1mol?L?1��CH3COONa��Һ��������Һ��c��NO3?����c��NO2-����c��CH3COO?���ɴ�С��˳��Ϊ ��(��֪HNO2�ĵ��볣��Ka=7.1��10-4mol?L?1��CH3COOH�ĵ��볣��K a=1��7��10-5mol?L?1)
��4)���л������ӡ�Al2Cl7����AlCl4����ɵ�����Һ�������Һʱ�����ڸ���Ʒ�ϵ������
����ƷӦ�ӵ�Դ�� ������֪��ƹ����в����������������л������Ӳ�����缫��Ӧ�������缫��ӦʽΪ ��������AlCl3ˮ��Һ�����Һ������������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�꽭��ʡ�Ͼ��С��γ��и���һģ��ѧ�Ծ��������棩 ���ͣ�ѡ����
����ҹ���ѧ���о���������������H2S����ЧԤ�����ಡ�������Գմ�֢�������й�H2S��˵����ȷ����
A��H2S���ڷǵ���� B��������H2S���ɺ����ʽ������
C����������H2S�������� D��H2Sֻ�л�ԭ��û��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�꽭��ʡ���Ƹ۵����и���һģ��ѧ�Ծ��������棩 ���ͣ�ѡ����
��NAΪ�����ӵ�������ֵ������˵����ȷ����
A��0.1mol Cl2������NaOH��Һ��Ӧ��ת�Ƶ��ӵ���ĿΪ0.2NA
B��0.1mol����ϩ�к���̼̼˫������ĿΪ0.4NA
C����״���£�11.2L�Ҵ��к����ǻ�����ĿΪ0.5NA
D��4.6g��NO2��N2O4��ɵĻ�����к�����ԭ�ӵ���ĿΪ0.2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�꽭�ճ����и�����һ�ε����Ծ���ѧ�Ծ��������棩 ���ͣ������
��14�֣�ij�����������̿���п����Ҫ�ɷ�ΪMnO2��ZnS�����������FeS��CuS��Al2O3�����ʣ�Ϊԭ����ȡZn��MnO2��
��1����һ�������£��������ֿ����������Һ������ã���ƽ���µĻ�ѧ����ʽ��
MnO2 + FeS + H2SO4 MnSO4 + Fe2(SO4)3 + S + H2O
MnSO4 + Fe2(SO4)3 + S + H2O
��2�������ú���Mn2+��Fe3+��Cu2+��Al3+��Zn2+��������Һ�����µĹ�ҵ���̽��в�����������Һ��IV���������Һ��IV������MnO2��Zn��
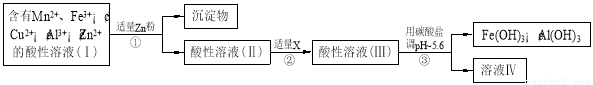
a���������м�Zn�ۺ�����Ӧ�����ӷ���ʽΪ ��
b���������м�������X��������ʲô ��X����ѡ��Ļ�ѧʽ�� ��
c��������������̼���εĻ�ѧʽ�� ��
��3��Ϊ�˴����������в�����Fe(OH)3��Al(OH)3����������л���Al(OH)3��������������µ��й�����ͼ
a��AlCl3��Һ��NaAlO2��Һ��Ӧ����AI(OH)3�����ӷ���ʽΪ �����ܹ��õ�n molAl(OH)3�������ĵ�NaOH��HCl����������mol���ֱ�Ϊ �� ��
b����ʹ���������̻��մ�������Ƚ�����������������������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�꽭�ճ����и�����һ�ε����Ծ���ѧ�Ծ��������棩 ���ͣ�ѡ����
�мס���������ȫ��ͬ��װ�ã��ֱ������ǵIJ����װ��1.06 g Na2CO3��0.84 g NaHCO3���Թ��и���10 mL��ͬŨ�ȵ����ᣨ����ͼ����ͬʱ����������е�����ȫ��������Ե��Թ��У�����������ȷ����

A����װ�õ������������ʴ�
B�������������������ͬ����һ����c(HCl)��2 mol/L
C�������������������ͬ����һ����c(HCl)��1 mol/L
D����������Һ��Na+��Cl�������ʵ�����ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�꽭�ճ����и�����һ�ε����Ծ���ѧ�Ծ��������棩 ���ͣ�ѡ����
����ʵ����̺������漰�����ӷ�Ӧ����ʽ�϶���ȷ����
A����ȥ����ͭ��Һ�е����������������Ʊ��������壺2Fe2+ + Cl2 2Fe3+ + 2Cl��
2Fe3+ + 2Cl��
B�������ϩȩCH2��CHCHO�к���̼̼˫����CH2��CHCHO + Br2 CH2Br��CHBr��CHO
CH2Br��CHBr��CHO
C����Ba(OH)2��Һ�м��������NH4HSO4��Һ��Ba2+ + 2OH��+ NH4+ + H+ + SO42�� BaSO4�� + NH3��H2O + H2O
BaSO4�� + NH3��H2O + H2O
D������0.1 mol���ʵ���������ϡ��Һ�м���7.8 g Na2O2��4Na2O2 + 4Fe2+ + 6H2O 4Fe(OH)3 ��+ 8Na+ + O2��
4Fe(OH)3 ��+ 8Na+ + O2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ��㶫ʡ�����и�����һ�ε��п������ۻ�ѧ�Ծ��������棩 ���ͣ�������
��17�֣���ҵ����NH3��CO2��Ӧ�ϳ����أ�
2NH3��g��+ CO2��g�� CO(NH2)2��g��+ H2O��g�� ��H1 = -536.1 kJ��mol��1
CO(NH2)2��g��+ H2O��g�� ��H1 = -536.1 kJ��mol��1
��1���˷�Ӧ��ƽ�ⳣ������ʽK= �������¶ȣ�Kֵ ��������С�䣩��
��2�������������䣬���з�����ͬʱ���ѧ��Ӧ���ʺ����ز��ʵ��� ��
A��ͨ�뺤�� B����С���
C��������� D����ȥ��ϵ�е�ˮ����
��3�����ؿ����ڴ�������β����CO(NH2)2��g����β����NO��Ӧ����CO2��N2��H2O��g���ų�����֪��4NH3��g��+ 6NO��g��= 5N2��g��+ 6H2O��g�� ��H2 = -1806.4 kJ��mol��1��д��CO(NH2)2��g����NO��Ӧ���Ȼ�ѧ����ʽ ��
ijС��ģ�ҵ�ϳ����أ�̽����ʼ��Ӧ��İ�̼��[n��NH3��/n��CO2��]�����غϳɵ�Ӱ�졣�ں�����1L�����У��������ʵ���Ϊ3mol��NH3��CO2�Բ�ͬ�İ�̼�Ƚ��з�Ӧ��ʵ����ƽ����ϵ�и���ֵı仯��ͼ��ʾ���ش����⣺

��4����a��b�߷ֱ��ʾNH3��CO2ת���ʵı仯�����б�ʾNH3ת���ʵ��� ����a��b���ߡ�
��5����a��b�߷ֱ��ʾNH3��CO2ת���ʵı仯��c�߱�ʾƽ����ϵ��������������ı仯����M���Ӧ��yֵ��д��������̣������ȷ��0.1����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�걱���в�ƽ���߶���ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����л���������˳���칹�����
A��CH3CH3 B��CH2��CH2 C��CH3CH��CH2 D��CH3CH��CHCH3
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com