
| A.x="3"
| B.N的化合价为+3 |
| C.阴离子B电子式可能为 | |
| D.此反应是非氧化还原反应 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
| A.①② | B.①③ | C.①④ | D.③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
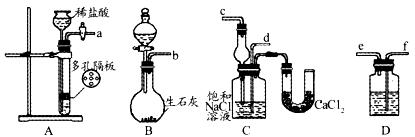
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

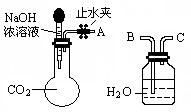
| 实验操作 | 实验现象 | 结论 | |
| ① 取少量白色固体于试管中,加足量水溶解,再加足量BaCl2溶液 | | | |
| ② 过滤,取2 mL滤液于试管中 | |||
| ③ | | | |
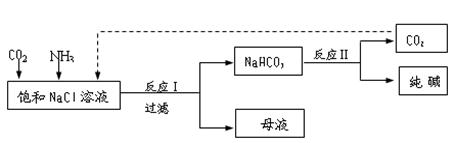
 NaHCO3↓+NH4Cl,处理母液的两种方法如下。
NaHCO3↓+NH4Cl,处理母液的两种方法如下。查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
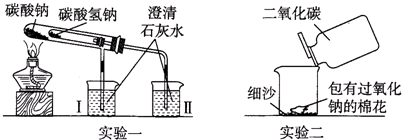
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.二氧化硫通入品红试液中红色褪去,说明二氧化硫具有还原性 |
| B.利用金属与盐酸反应,可比较铝和镁的金属性强弱 |
| C.向鸡蛋清溶液中加入甲醛溶液,可使蛋白质的溶解度降低而析出 |
| D.制备乙酸乙酯的实验中,可用浓氢氧化钠溶液代替饱和碳酸钠溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com