



| ||
| ||
 ,二氧化硅属于原子晶体,故答案为:
,二氧化硅属于原子晶体,故答案为: ,原子晶体;
,原子晶体;
| ||
| ||


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:
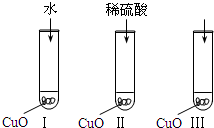 (2007?汕头二模)氧化铜是一种黑色固体,可溶于稀硫酸.某同学想知道是稀硫酸的哪种粒子(H2O,H+,SO42-)能使氧化铜溶解.请你和他一起通过如图Ⅰ、Ⅱ和Ⅲ三个实验完成这次探究活动.
(2007?汕头二模)氧化铜是一种黑色固体,可溶于稀硫酸.某同学想知道是稀硫酸的哪种粒子(H2O,H+,SO42-)能使氧化铜溶解.请你和他一起通过如图Ⅰ、Ⅱ和Ⅲ三个实验完成这次探究活动.查看答案和解析>>
科目:高中化学 来源: 题型:
 (2007?汕头二模)2012年6月16日我国成功发射了“神州九号”.这标志着中国人的太空时代又前进了一大步.发射“神九”时用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气.已知:
(2007?汕头二模)2012年6月16日我国成功发射了“神州九号”.这标志着中国人的太空时代又前进了一大步.发射“神九”时用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气.已知:查看答案和解析>>
科目:高中化学 来源: 题型:
 ,则苯氯乙酮不可能具有的化学性质是
,则苯氯乙酮不可能具有的化学性质是







查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com