
| A. | 锗是一种金属性很强的元素 | B. | 锗的单质具有半导体的性能 | ||
| C. | 锗化氢(GeH4)稳定性很强 | D. | 锗酸(H4GeO4)是难溶于水的弱酸 |
分析 处于金属区与非金属区的交界线上的元素常用于做半导体材料,锗和硅处于同一主族,根据同主族元素的金属性、非金属性的递变规律比较最高价含氧酸的酸性,类比硅酸判断溶解性等性质.
解答 解:A.锗处于金属区与非金属区的交界线上,元素金属性和非金属性都较弱,反应中既不易得电子,也不易失去电子,故A错误;
B.锗处于金属区与非金属区的交界线上,既有金属性又有非金属性,常用于做半导体材料,故B正确;
C.锗处于金属区与非金属区的交界线上,元素金属性和非金属性都较弱,则锗化氢(GeH4)稳定性较弱,故C错误;
D.锗和硅处于同一主族,主族元素的非金属性从上到下逐渐减弱,则硅的非金属性大于锗,非金属性越强,对应的最高价氧化物的水化物的酸性越强,所以酸性比硅酸弱,为弱酸,碳酸溶液水,硅酸不溶于水,推知锗酸(H4GeO4)应难溶于水,故D正确;
故选D.
点评 本题考查位置结构性质的相互关系,题目难度不大,注意掌握同主族元素的性质的递变性和相似性,明确元素周期表结构、元素周期律内容为解答关键,试题有利于提高学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
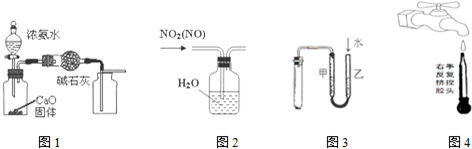
| A. | 用图1装置制取并收集干燥纯净的NH3 | |
| B. | 用图2所示装置可除去NO2中的NO | |
| C. | 用图3所示装置检验装置的气密性 | |
| D. | 图④是实验室洗涤胶头滴管的操作 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
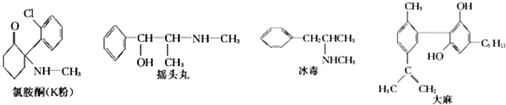
| A. | 冰毒能与盐酸反应 | |
| B. | 摇头丸具有两性 | |
| C. | 1molK粉最多可以与4molH2发生加成反应 | |
| D. | 适当条件下,1mol大麻最多可与3mol Br2发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
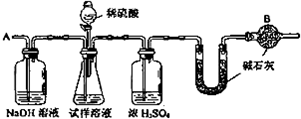
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2?Ba2++2 OH- | B. | H3PO4?3 H++PO43- | ||
| C. | NaHCO3═Na++H++CO3 2- | D. | HClO?H++ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HC1的电子式: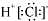 | B. | 乙烯分子的结构简式:CH2CH2 | ||
| C. | S2-的原子结构示意图: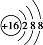 | D. | H2O2的电子式: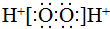 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
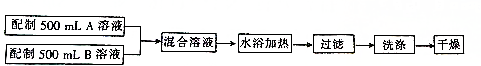
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com