
| 编号 | 操 作 | 实验现象 |
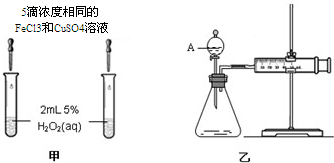
| ① | 分别在试管A、B中加入 5mL 5% H2O2溶液,各滴入1~2 滴1mol/L FeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中;将试管B放入盛有40℃左右热水的烧杯中. | 试管A中不再产生气泡;试管B中产生的气泡量增大 |
| ② | 另取两支试管分别加入 5mL 5%H2O2溶液和 5mL10%H2O2溶液. | 试管A、B中均未明显见到有气泡产生 |
分析 (1)在FeCl3催化作用下,过氧化氢分解生成氧气和水;
(2)实验①中试管A、B中只有温度不同,滴加FeCl3溶液双氧水的分解速率增大,现象明显;
(3)现象不明显可以提高反应速率,结合影响化学反应速率的外界因素解答;
(4)①根据反应生成气体的快慢分析;根据H2O2分解的催化作用有可能是氯离子起的作用,改为Fe2(SO4)3使阴离子相同,更为合理;
②该反应是通过反应速率分析的,所以根据v=$\frac{△c}{△t}$判断.
解答 解:(1)过氧化氢分解,FeCl3在此反应中作催化剂,起催化作用,能加快过氧化氢分解产生氧气的速率,其反应的方程式为:2H2O2$\frac{\underline{\;三氯化铁\;}}{\;}$2H2O+O2↑,
故答案为:2H2O2$\frac{\underline{\;三氯化铁\;}}{\;}$2H2O+O2↑;
(2)分别在试管A、B中加入 5mL 5% H2O2溶液,各滴入1~2 滴1mol/L FeCl3溶液.待试管中均有适量气泡出现,说明过氧化氢分解能发生,试管A、B中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中;将试管B放入盛有40℃左右热水的烧杯中,两支试管不同点是试管A的温度比试管B的温度低,说明研究的是温度对反应速率的影响,
故答案为:研究温度对H2O2分解速率的影响;
(3)另取两支试管分别加入 5mL 5%H2O2溶液和 5mL10%H2O2溶液,试管A、B中均未见气泡产生,说明在常温或者无催化剂时,双氧水分解很慢,为加快反应速率,可从温度升温、或使用催化剂,实验②的目的是探究温度和催化剂对反应速率的影响,
故答案为:探究温度和催化剂对反应速率的影响; 将两支试管同时放入盛有相同温度热水的烧杯中,或向两支试管中同时滴入2滴1mol/L FeCl3溶液,观察产生气泡的速率;
(4)①该反应中产生气体,而且反应放热,所以可根据反应产生气泡快慢来判断反应速率大小,H2O2分解的催化作用有可能是氯离子起的作用,改为Fe2(SO4)3使阴离子相同,这样可以控制阴离子相同,排除阴离子的干扰,更为合理,
故答案为:溶液中气泡产生的速率;控制阴离子相同,排除阴离子的干扰;
②该反应是通过生成气体的反应速率分析判断的,所以根据v=$\frac{△c}{△t}$可知,需要测量的数据是产生40ml气体所需要的时间,
故答案为:产生40ml气体所需要的时间.
点评 本题主要考查外界条件对反应速率的影响及催化剂的作用,侧重于学生的实验探究能力的考查,解答时须注意实验的原理,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 它是离子化合物 | B. | 加热时,它很稳定,不发生分解 | ||
| C. | 它能跟碱发生反应 | D. | 它可由PH3和HI化合而成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 得电子能力:A>B>Cm+>Dn+ | B. | 还原性:An->Bm->C>D | ||
| C. | 原子半径:D>C>B>A | D. | 离子半径:An->Bm->Cm+>Dn+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
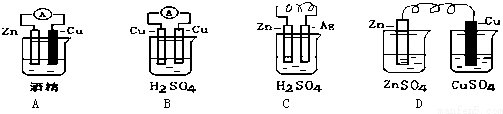
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3易液化,液氨常用作制冷剂 | |
| B. | 与金属反应时,稀HNO3可能被还原为更低价态,则稀HNO3氧化性强于浓HNO3 | |
| C. | 氨盐受热易分解,因此贮存氨态氮肥时要密封保存,并放在阴凉通风处 | |
| D. | 稀HNO3和活泼金属反应时不能得到氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
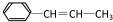 ,它可能具有的性质是( )
,它可能具有的性质是( )| A. | 可以发生加成、取代、氧化反应 | |
| B. | 能使溴水褪色,但不能使酸性高锰酸钾褪色 | |
| C. | 能发生加聚反应,其生成物可用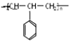 来表示 来表示 | |
| D. | 易溶于水,也易溶于有机溶剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核内有 10 个中子的氧原子:${\;}_{8}^{16}$O | |
| B. | 氢氧根离子的电子式: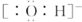 | |
| C. | 基态 Cr 的价电子排布式为:3d44s2 | |
| D. | 某元素原子的电子排布图: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com