
(15分)二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。
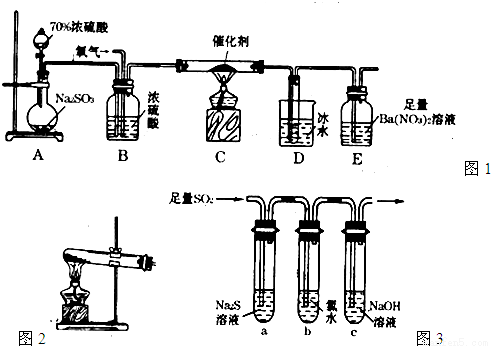
(1)实验室用图1装置测定SO2催化氧化为SO3的转化率。(已知SO3熔点为16.8℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响。)
①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作: 。
②实验过程中,需要通入氧气。试写出一个用如图2所示装置制取氧气的化学方程式: 。
③当停止通入SO2熄灭酒精灯后,需要继续通一段时间的氧气,其目的是: 。
④实验结束后,若装置D增加的质量为mg,装置E中产生白色沉淀的质量为ng,则此
条件下二氧化硫的转化率是 (用含字母的代数式表示,不用化简)。
(2)某学习小组设计用如图3装置验证二氧化硫的化学性质。
①能说明二氧化硫具有氧化性的实验现象为: 。
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分三份,分别进行如下实验。
方案I:向第一份溶液中加入AgNO3溶液,有白色沉
淀生成。
方案II:向第二份溶液中加入品红溶液,红色褪去。
方案III:向第三份溶液中加入BaC12溶液,产生白色沉淀
上述方案中合理的是 (填“I”、“II”、或“III”);
试管b发生反应的离子方程式: 。
③当通入二氧化硫至试管c中溶液显中性时,该溶液中
c(Na+)= (用含硫微粒浓度的代数式表示)。
(除说明外其余2分,共15分)
(1) ①打开分液漏斗上口的活塞,旋开分液漏斗的旋塞,缓慢滴加。
②2KClO3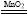 2KCl+3O2 或2KMnO4
2KCl+3O2 或2KMnO4 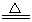 K2MnO4+MnO2+O2
K2MnO4+MnO2+O2
③使残留在装置中的二氧化硫和三氧化硫被充分吸收。
④ 
(2)①试管a中出现淡黄色浑浊
②Ⅲ合理(1分), SO2+Cl2+2H2O=4H++SO42-+2Cl-
③ 2 C(SO32-)+ C(HSO3-)
【解析】
试题分析:(1)①用分液漏斗向圆底烧瓶中滴加浓硫酸的操作打开分液漏斗上口的活塞,旋开分液漏斗的旋塞,缓慢滴加;
②图2为加热固体制取气体的装置,所以用该装置制取氧气可以用2KClO3 2KCl+3O2 也可以用 2KMnO4
2KCl+3O2 也可以用 2KMnO4  K2MnO4+MnO2+O2
K2MnO4+MnO2+O2
③为确保实验的准确度,要保证二氧化硫和三氧化硫的量的测定准确,当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气,可以让装置中的二氧化硫和三氧化硫充分被后面的装置吸收;
④装置D增加的质量为mg,及生成三氧化硫的质量是mg,物质的量是mg/80g/mol,装置E 中产生白色沉淀为硫酸钡沉淀,质量为ng,则吸收的二氧化硫的物质的量是ng/233g/mol,根据元素守恒,则二氧化硫的转化率=mg/80g/mol/(mg/80g/mol+ng/233g/mol)×100%= ;
;
(2)①二氧化硫与硫化钠溶液反应生成淡黄色的单质硫,证明二氧化硫有氧化性,所以能说明二氧化硫具有氧化性的实验现象为试管a中出现淡黄色浑浊
②二氧化硫与氯水反应生成硫酸根离子和氯离子,所以方案I:溶液中存在氯离子产生的白色沉淀不能证明是硫酸银沉淀,所以不能证明溶液中存在硫酸根离子,错误;方案II:使品红溶液褪色只能证明b溶液中含有未完全反应的次氯酸,不能证明有硫酸根离子,错误;方案III:与钡离子反应生成沉淀的在b溶液中只能是硫酸根离子,证明b溶液中存在硫酸根离子,说明二氧化硫被氧化,具有还原性,所以方案III合理;试管b发生反应的离子方程式:SO2+Cl2+2H2O=4H++SO42-+2Cl-
③二氧化硫与氢氧化钠溶液反应生成亚硫酸钠或亚硫酸氢钠或二者都有,溶液呈中性,说明c(H+)= c(OH-),根据电荷守恒规律,所以c(Na+)=2 C(SO32-)+ C(HSO3-)。
考点:考查仪器的操作方法,氧气的制取,转化率的计算,二氧化硫的性质验证实验,化学方程式、离子方程式的书写,实验方案的判断


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2013-2014江西省九江七校下学期期中联考高二化学试卷(解析版) 题型:选择题
下列分子式表示的物质一定是纯净物的是( )
A.C5H10 B.C7H8 C.CH4O D.C2H4Cl2
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省高二下学期期末考试化学试卷(解析版) 题型:选择题
下列各项实验操作不能达到目的的是
A.在蔗糖溶液中加入几滴稀硫酸,水浴加热5 min,加入NaOH溶液至碱性,
再加入银氨溶液并水浴加热检验葡萄糖的生成
B.苯中混有苯酚可与足量氢氧化钠溶液反应后分液除去
C.使C2H5Br和NaOH溶液混合后水解,取上层清液,滴加AgNO3溶液检验溴元素
D.只用溴水一种试剂即可鉴别甲苯、己烯、乙醇、四氯化碳四种液体
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省高一下学期期末考试化学试卷(解析版) 题型:选择题
有A、B、C、D四块金属片,进行如下实验:①A、B用导线相连后,同时浸入稀H2SO4溶液中,A极为负极;②C、D用导线相连后,同时浸入稀H2SO4溶液中,电流由C经导线流向D;③A、C相连后,同时浸入稀H2SO4溶液中,C极产生大量气泡;④B、D相连后,同时浸入稀H2SO4溶液中,B极发生氧化反应。据此,判断四种金属的活动性顺序是( )
A.A>B>D>C B.A>C>D>B C.C>A>B>D D.B>D>C>A
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省高一下学期期末考试化学试卷(解析版) 题型:选择题
下列叙述正确的是( )
A.石油化工中可通过催化裂化,可以获得碳原子数较少的轻质油
B.Mg、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到
C.煤的气化就是将煤在高温条件下由固态转化为气态的物理变化过程
D.在空气质量日报中CO2含量属于空气污染指数
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省上饶市高三六校第二次联考理综化学试卷(解析版) 题型:选择题
在阿司匹林的结构简式(如图)中①②③④⑤⑥分别标出了其分子不同的键。将阿司匹林与足量NaOH溶液共热时,发生反应时断键的位置是( )
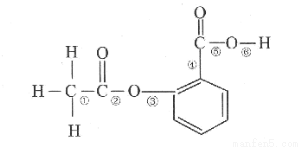
A.①④
B.②⑤
C.③④
D.②⑥
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省上饶市第二学期期末教学质量测试高二化学试卷(解析版) 题型:填空题
【化学———化学与技术】
锶(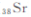 )元素广泛存在于矿泉水中,是一种人体必需的微量元素,在元素周期表中与
)元素广泛存在于矿泉水中,是一种人体必需的微量元素,在元素周期表中与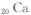
和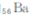 同属于第ⅡA族?
同属于第ⅡA族?
(1)碱性:Sr(OH)2 Ba(OH)2(填“>”或“<”);锶的化学性质与钙和钡类似,用原子结构的观点解释其原因是 ?
(2)碳酸锶是最重要的锶化合物?用含SrSO4和少量BaSO4?BaCO3?FeO?Fe2O3?Al2O3?SiO2的天青石制备SrCO3,工艺流程如下(部分操作和条件略):
Ⅰ.将天青石矿粉和Na2CO3溶液充分混合,过滤;
Ⅱ.将滤渣溶于盐酸,过滤;
Ⅲ.向Ⅱ所得滤液中加入浓硫酸,过滤;
Ⅳ.向Ⅲ所得滤液中先加入次氯酸,充分反应后再用氨水调pH约为7,过滤;
Ⅴ.向Ⅳ所得滤液中加入稍过量NH4HCO3,充分反应后,过滤,将沉淀洗净,烘干,得到SrCO3?
已知:ⅰ.相同温度时的溶解度:BaSO4<SrCO3<SrSO4<CaSO4
ⅱ.生成氢氧化物沉淀的pH
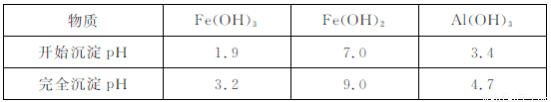
①Ⅰ中,反应的化学方程式是 ?
②Ⅱ中,能与盐酸反应溶解的物质有 ?
③Ⅳ的目的是 ?
④该工艺流程中NH4HCO3含有的化学键是 ?
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省上饶市第二学期期末教学质量测试高二化学试卷(解析版) 题型:选择题
解释下列事实的方程式正确的是
A.加热可增强纯碱溶液去污力:
B.用稀硝酸洗涤做过银镜反应的试管:
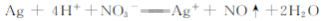
C.向煤中加入石灰石可减少煤燃烧时SO2的排放:

D.碳酸氢钠溶液与少量澄清石灰水混合出现白色沉淀:
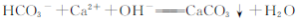
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省盐城市高二下学期期终考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.向蒸馏水中滴加浓H2SO4时,KW不变
B.常温下,0.005mol·L-1Ba(OH)2溶液pH为12
C.Na2CO3水解的离子方程式为:CO32- + 2H2O H2CO3 + 2OH-
H2CO3 + 2OH-
D.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com