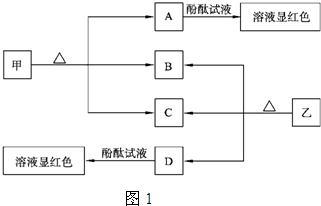
解答:解:I、甲、乙均是离子化合物,且阴、阳离子个数比为1:1.甲是发酵粉的主要成分,乙是一种常用的化肥,B、D常温常压下是气体,甲分解生成A、B、C,则甲为NaHCO
3,A为Na
2CO
3,D溶液显碱性,则D为氨气,所以乙为NH
4HCO
3,
(1)甲为碳酸氢钠,其俗名为小苏打,故答案为:小苏打;
(2)A为碳酸钠,碳酸根离子水解使溶液显碱性,水解反应为CO
32-+H
2O?HCO
3-+OH
-,D为氨气,水溶液中一水合氨电离使溶液显碱性,电离为NH
3?H
2O?NH
4++OH
-,
故答案为:碱性;不同,A溶液显碱性是因为碳酸根离子发生水解,CO
32-+H
2O?HCO
3-+OH
-,D溶液显碱性是因为:NH
3?H
2O?NH
4++OH
-;
(3)向饱和氯化钠溶液中通入气体D至饱和后,再通入足量的气体B可制得物质甲,反应为NaCl+NH
3+CO
2+H
2O=NaCO
3+NH
4Cl,故答案为:NaCl+NH
3+CO
2+H
2O=NaCO
3+NH
4Cl;
II、(1)①平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比,则K=
,故答案为:
;
②a.恒温、恒容条件下,该反应为反应前后体积不等的反应,容器内的压强不发生变化,即达到平衡状态,故a不选;
b.一定条件下,CH
3OH分解的速率和CH
3OH生成的速率相等,正逆反应速率相等,即达到平衡状态,故b不选;
c.一定条件下,CO、H
2和CH
3OH的浓度保持不变,达到平衡状态,故c不选;
d.一定条件下,单位时间内消耗2mol CO,同时生成1mol CH
3OH,为正反应方向的关系,不能确定正逆反应速率的关系,所以不能确定达到平衡状态,故d选;
故答案为:d;
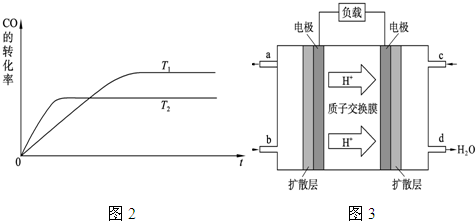
(2)①由图可知,T
2先达到平衡,温度大,温度高时CO的转化率低,则正反应为放热反应,所以△H<0,故答案为:<;
②由K=
,升高温度平衡逆向移动,则升高温度K减小,T
1<T
2,所以K
1>K
2,故答案为:>;
③增加甲醇产率,即化学平衡正向移动,则
a.该反应为放热反应,升高温度,化学平衡逆向移动,故a不选;
b.将CH
3OH(g)从体系中分离,平衡正向移动,可提高甲醇的产率,故b选;
c.使用合适的催化剂,对化学平衡移动无影响,不能提高产率,故c不选;
d.充入He,使体系总压强增大,反应体系中物质的浓度不变,平衡不移动,不能提高产率,故d不选;
故答案为:b;
(3)①2CH
3OH(l)+3O
2(g)=2CO
2(g)+4H
2O(g)△H=-a kJ?mol
-1,
②2CO(g)+O
2(g)=2CO
2(g)△H=-b kJ?mol
-1,
③H
2O(g)=H
2O(l)△H=-c kJ?mol
-1,
根据盖斯定律可知,则
可得CH
3OH(l)+O
2(g)=CO(g)+2H
2O(l)△H=
kJ/mol=
kJ/mol,
故答案为:
kJ/mol;
(4)由图中质子的移动方向可知,a为负极,b为正极,在2CH
3OH+3O
2=2CO
2+4H
2O中C元素的化合价升高,氧气中氧元素的化合价降低,则甲醇为负极,氧气为正极,
①该电池工作时,b口通入的物质为CH
3OH,c口通入的物质为O
2,故答案为:CH
3OH;O
2;
②正极中氧气得电子,正极反应为O
2+4e
-+4H
+=2H
2O,故答案为:O
2+4e
-+4H
+=2H
2O.



 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案


 C3H6N6+6 NH3+3 CO2
C3H6N6+6 NH3+3 CO2 C3H6N6+6 NH3+3 CO2
C3H6N6+6 NH3+3 CO2