
【题目】磷单质及其化合物有广泛应用.
(1)磷酸二氢钙,广泛用于动物的饲料添加剂.目前其制备的新工艺方法有:石灰法:用石灰石中和磷酸,控制终点pH为3.2,既得磷酸二氢钙.请写出该反应的化学方程式;若有1×103kg石灰石最多能生产kg磷酸二氢钙.
(2)用石英、焦炭与磷灰石[主要成分Ca5(PO4)3F]在高温下制备黄磷(P4)的化学方程式为:4Ca5(PO4)3F+21SiO2+30C=3P4+20CaSiO3+30CO↑+SiF4↑:在此反应中,副产物矿渣可用来 .
(3)三聚磷酸可视为三个磷酸分子(磷酸结构简式如图 ![]() )之间脱去两个水分子的产物,其结构简式为 . 三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为 .
)之间脱去两个水分子的产物,其结构简式为 . 三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为 .
(4)次磷酸钠(NaH2PO2)可用于化学镀镍.化学镀镍的溶液中含有Ni2+和H2PO2﹣ , 在酸性条件下发生下述反应:请配平该反应离子方程式Ni2++H2PO2﹣+═Ni++H2PO3﹣+ .
(5)H3PO2可用电渗析法制备,“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):①写出阳极的电极反应式 .
②分析产品室可得到H3PO2的原 . 
【答案】
(1)CaCO3+2H3PO4=Ca(H2PO4)2+H2O+CO2↑;2.34×103
(2)制水泥
(3)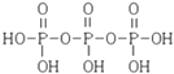 ;Na5P3O10
;Na5P3O10
(4)1;1;H2O;1;1;2H+
(5)4OH﹣﹣4e﹣=O2↑+2H2O;阳极室的H+穿过阳膜扩散至产品室,原料室的H2PO2﹣穿过阴膜扩散至产品室,二者反应生成H3PO2
【解析】解:(1)碳酸钙与硫酸反应生成磷酸二氢钙和二氧化碳和水,方程式为:CaCO3+2H3PO4=Ca(H2PO4)2+H2O+CO2↑,设生成磷酸二氢钙的质量为m,依据方程式:CaCO3+2H3PO4=Ca(H2PO4)2+H2O+CO2↑,
100 234
1×103kg m
解得m=2.34×103kg;
所以答案是:CaCO3+2H3PO4=Ca(H2PO4)2+H2O+CO2↑;2.34×103;(2)用石英、焦炭与磷灰石[主要成分Ca5(PO4)3F]在高温下制备黄磷(P4)的化学方程式为:4Ca5(PO4)3F+21SiO2+30C=3P4+20CaSiO3+30CO↑+SiF4↑:在此反应中,副产物矿渣含有硅酸钙,硅酸钙为制备水泥的主要原料,所以答案是:制水泥;(3)相邻的磷酸分子中1个去掉羟基,一个去掉氢原子即可形成三聚磷酸,结构简式为  ;三聚磷酸与5分子氢氧化钠反应生成三聚磷酸钠化学式为:Na5P3O10;所以答案是:
;三聚磷酸与5分子氢氧化钠反应生成三聚磷酸钠化学式为:Na5P3O10;所以答案是:  ;Na5P3O10;(4)由氧化还原反应中化合价升降相等进行配平:镍元素的化合价降低了2价,磷元素的化合价升高的2价,所以根据原子守恒结合电荷守恒可得配平的方程式为:H2O+Ni2++H2PO2﹣═Ni+H2PO3﹣+2H+ , 镍离子被还原成金属Ni,还原产物为Ni,所以答案是:1;1;H2O;1;1;2H+;(5)①由于阳极中阴离子为硫酸根离子、氢氧根离子和H2PO2﹣ , 其中放电能力最强的是氢氧根离子,则阳极发生的电极反应为:4OH﹣﹣4e﹣=O2↑+2H2O;所以答案是:4OH﹣﹣4e﹣=O2↑+2H2O;②产品室可得到H3PO2的原因是:阳极室的H+穿过阳膜扩散至产品室,原料室的H2PO2﹣穿过阴膜扩散至产品室,二者反应生成H3PO2 , 所以答案是:阳极室的H+穿过阳膜扩散至产品室,原料室的H2PO2﹣穿过阴膜扩散至产品室,二者反应生成H3PO2 .
;Na5P3O10;(4)由氧化还原反应中化合价升降相等进行配平:镍元素的化合价降低了2价,磷元素的化合价升高的2价,所以根据原子守恒结合电荷守恒可得配平的方程式为:H2O+Ni2++H2PO2﹣═Ni+H2PO3﹣+2H+ , 镍离子被还原成金属Ni,还原产物为Ni,所以答案是:1;1;H2O;1;1;2H+;(5)①由于阳极中阴离子为硫酸根离子、氢氧根离子和H2PO2﹣ , 其中放电能力最强的是氢氧根离子,则阳极发生的电极反应为:4OH﹣﹣4e﹣=O2↑+2H2O;所以答案是:4OH﹣﹣4e﹣=O2↑+2H2O;②产品室可得到H3PO2的原因是:阳极室的H+穿过阳膜扩散至产品室,原料室的H2PO2﹣穿过阴膜扩散至产品室,二者反应生成H3PO2 , 所以答案是:阳极室的H+穿过阳膜扩散至产品室,原料室的H2PO2﹣穿过阴膜扩散至产品室,二者反应生成H3PO2 .


科目:高中化学 来源: 题型:
【题目】下列关于化学键的说法正确的是( )
A. 离子化合物中只存在离子键B. 共价化合物中只存在共价键
C. 物质中都含化学键D. 只含非金属元素的物质一定不含离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用图甲所示装置进行实验,若图乙中横坐标x表示流入电极的电子的物质的量.下列叙述错误的是( ) 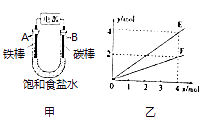
A.E表示反应生成NaOH的物质的量
B.E表示反应消耗H2O的物质的量
C.F表示反应生成H2或Cl2的物质的量
D.F表示反应消耗NaCl的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求写热化学方程式:
(1)已知稀溶液中,1 mol H2SO4与NaOH溶液恰好完全反应时,放出114.6 kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式____________________________。
(2)碳的燃烧热为393.50 kJ·mol-1,写出表示C燃烧热的热化学方程式:______________。
(3)已知CO转化成CO2的能量关系如下图所示。写出该反应的热化学方程式:_______。

(4)25℃、101 kPa条件下充分燃烧一定量的丁烷气体放出热量为Q kJ,经测定,将生成的CO2通入足量澄清石灰水中产生25 g白色沉淀,写出表示丁烷燃烧热的热化学方程式________。
(5)已知下列热化学方程式:
①CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol
②C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ/mol
③H2(g)+![]() O2(g)===H2O(l)ΔH3=-285.8 kJ/mol
O2(g)===H2O(l)ΔH3=-285.8 kJ/mol
写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下: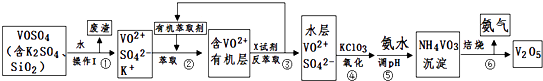
请回答下列问题:
(1)步骤①所得废渣的成分是(写化学式),操作I的名称 .
(2)步骤②、③的变化过程可简化为(下式R表示VO2+ , HA表示有机萃取剂):R2(SO4)n (水层)+2nHA(有机层)2RAn(有机层)+nH2SO4 (水层)
②中萃取时必须加入适量碱,其原因是 .
③中X试剂为 .
(3)④的离子方程式为 .
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为 . 若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)< . (已知:25℃时,Ksp[Fe(OH)3]=2.6×10﹣39)
(5)该工艺流程中,可以循环利用的物质有和 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化工厂用来检查氯气管道是否漏气的反应为:3Cl2+8NH3→N2+6NH4Cl.
(1)在该反应中,被还原的元素是;作为还原剂的物质是 .
(2)在方程式上标出电子转移的方向和数目.
(3)若标准状况下有33.6LCl2参加反应,则被氧化的NH3的物质的量为mol.
(4)已知当氨气不足量时,反应产物是N2和HCl.若某次反应所得产物中,NH4Cl和HCl的物质的量相等,则参加反应的Cl2和NH3的物质的量之比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结合图回答问题: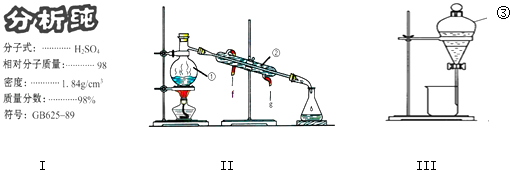
(1)学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容如图Ⅰ,现欲用此硫酸配制配制成浓度为0.50molL﹣1的稀硫酸100mL.①所需玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管外还需 .
②所取浓硫酸的体积为mL.
(2)写出上述装置Ⅱ中仪器的名称:②;③;
(3)若利用装置Ⅱ分离乙酸(沸点118℃)和乙酸乙酯(沸点77.1℃)的混合物,还缺少的仪器有 , 将仪器补充完整后进行的实验操作的名称为 .
(4)实验室常用装置Ⅲ分离碘水中的碘,该实验操作名称为 . 进行该操作时,需在碘水中加一试剂,在选择试剂时,下列性质你认为哪些性质是必需的:(填序号).①常温下为液态 ②I2在其中溶解程度大 ③与水互不相容 ④密度要比水大.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对实验Ⅰ~Ⅳ的实验操作现象判断正确的是( ) 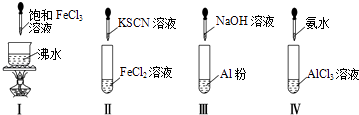
A.实验Ⅰ:产生红褐色沉淀
B.实验Ⅱ:溶液颜色变红
C.实验Ⅲ:放出大量气体
D.实验Ⅳ:先出现白色沉淀,后溶解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com