
| 1 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |


 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
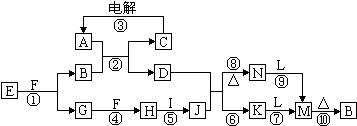
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、第1列元素均能形成M2O和M2O2型化合物 |
| B、第14列元素所形成的化合物种类最多 |
| C、第17列元素均有最高价氧化物R2O7 |
| D、最外层有两个电子的原子都在第2列 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、17% | B、25% |
| C、33% | D、50% |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 可判断可逆反应A2(g)+3B2(g)?2AB3(g)正反应是放热反应 可判断可逆反应A2(g)+3B2(g)?2AB3(g)正反应是放热反应 |
B、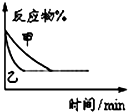 表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(s)的影响,乙的压强大 表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(s)的影响,乙的压强大 |
C、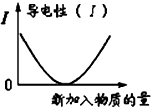 可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 |
D、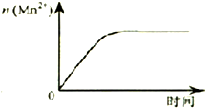 表示10mL 0.01 mol?L-1 KMnO4酸性溶液与过量的0.1mol?L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化 表示10mL 0.01 mol?L-1 KMnO4酸性溶液与过量的0.1mol?L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHSO4=Na++HSO4- |
| B、NaHSO4=Na++H++SO42- |
| C、NaHSO4=Na++H++S6++4O2- |
| D、NaHSO4=NaH2++SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com