
【题目】如图是化学教材中常用的喷泉实验装置(夹持仪器已略去),在烧瓶中充满干燥气体,而胶头滴管及烧杯中分别盛有液体。下列气体和液体的组合中不可能形成喷泉的是( )
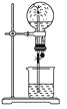
A.氯化氢和水
B.氧气和水
C.氨气和水
D.二氧化碳和氢氧化钠溶液
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向淀粉溶液中加适量20%H2SO4溶液,加热,冷却后加NaOH溶液至中性,再滴加少量碘水,溶液变蓝 | 淀粉未水解 |
B | 室温下,向 | 镁与盐酸反应放热 |
C | 室温下,向浓度均为 | 白色沉淀是BaCO3 |
D | 向 | H2O2具有氧化性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为一“铁链”图案,小明在图案上分别写了H2、CO2、Na2O、NaCl、FeCl3五种物质,图中相连的两种物质均可归属为一类,相交部分A、B、C、D为其相应的分类依据代号.请回答下列问题:
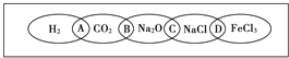
(1)请将分类依据代号填入相应的括号内:
(________)两种物质都不是电解质
(________)两种物质都是钠的化合物
(________)两种物质都是氧化物
(________)两种物质都是盐
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入上图中某种物质M的饱和溶液,继续煮沸至溶液呈红褐色.
①物质M的化学式为____________。
②证明有红褐色胶体生成的实验操作是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光电池在光照条件下可产生电压,如下装置可以实现光能源的充分利用,双极性膜可将水解离为H+和OH-,并实现其定向通过。下列说法不正确的是

A.该装置中的能量转化形式:光能→电能→化学能
B.双极性膜可控制其两侧溶液分别为酸性和碱性
C.光照过程中阳极区溶液中的n(OH-)基本不变
D.再生池中的反应:2V2+ +2H2O![]() 2V3+ +2OH-+ H2↑
2V3+ +2OH-+ H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烧杯A中盛放0.1mol/L的H2SO4溶液,烧杯B中盛放0.1mol/L的的CuCl2溶液(两种溶液均足量),组成的装置如图所示。下列说法不正确的是

A.A为原电池,B为电解池
B.当A烧杯中产生0.1mol气体时,B烧杯中产生气体的物质的量也为0.1mol
C.经过一段时间,B烧杯中溶液的浓度减小
D.将B中右侧石墨改为铜电极,电极上发生的反应不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,3—丁二烯在环己烷溶液中与溴发生加成反应时,会生成两种产物M和N(不考虑立体异构),其反应机理如图1所示;室温下,M可以缓慢转化为N,能量变化如图2所示。下列关于该过程的叙述错误的是
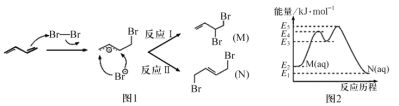
A.室温下,M的稳定性强于N
B.N存在顺反异构体
C.有机物M的核磁共振氢谱中有四组峰,峰面积之比为2:1:2:2
D.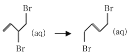 H=-(E2-E1)kJmol-1
H=-(E2-E1)kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酒精灯加热下列溶液,蒸干后灼烧,所得固体质量最大的是( )
A. 20 mL 2 mol/L FeCl3溶液 B. 40 mL 1 mol/L NaHCO3溶液
C. 20 mL 1 mol/L Na2SO3溶液 D. 40 mL 2 mol/L NH4HCO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】平衡:2NO2(g)![]() N2O4(g) ΔH<0。在测定NO2的相对分子质量时,下列条件中较为适宜的是( )
N2O4(g) ΔH<0。在测定NO2的相对分子质量时,下列条件中较为适宜的是( )
A.温度130℃,压强3.03×105PaB.温度25℃,压强1.01×105Pa
C.温度130℃,压强5.05×104PaD.温度0℃,压强5.05×104Pa
查看答案和解析>>
科目:高中化学 来源: 题型:
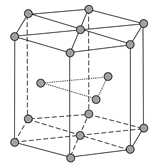
【题目】锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Zn原子核外电子排布式为__________洪特规则内容_____________
泡利不相容原理内容______________________
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能I1(Zn)__________I1(Cu)(填“大于”或“小于”)。原因是__________
(3)ZnF2具有较高的熔点(872℃ ),其化学键类型是__________;ZnF2不溶于有机溶剂而ZnCl2、ZnBr2、ZnI2能够溶于乙醇、乙醚等有机溶剂,原因是__________
(4)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为__________,配位数为____六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA,Zn的密度为__________g·cm-3(列出计算式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com