
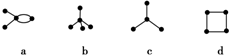
| A. | a和d互为同分异构体 | B. | b和c是同系物 | ||
| C. | a和d都能发生加成反应 | D. | b、c、d都能发生取代反应 |
分析 由碳架结构可知a为CH3C(CH3)=CH2,b为C(CH3)4,c为CH(CH3)3,d为环丁烷,结合有机物的结构和性质解答该题.
解答 解:A.a为CH3C(CH3)=CH2,d为环丁烷,二者分子式相同,结构不同,互为同分异构体,故A正确;
B.b为C(CH3)4,c为CH(CH3)3,二者都属于烷烃,结构相似,在组成上相差1个CH2,互为同系物,故B正确;
C.a的结构简式为(CH3)2C=CH2,含有碳碳双键,能发生加成反应,d为环烷烃,不含碳碳双键,不能发生加成反应,故C错误;
D.b、c、d都属于烃,一定条件下都可以发生取代反应,故D正确.
故选C.
点评 本题考查有机物的结构和性质,题目难度不大,注意根据有机物的结构模型判断有机物的种类,为解答该题的关键.


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案科目:高中化学 来源: 题型:解答题
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙一定是氯化钾溶液 | B. | 甲一定是氢氧化钡溶液 | ||
| C. | 丙不可能是碳酸钠溶液 | D. | 丁只能是硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两溶液的物质的量浓度相同 | |
| B. | 两溶液的c(H+)相同 | |
| C. | 等体积的两溶液分别与足量Zn反应,产生H2的量不同 | |
| D. | 将两溶液均稀释100倍后,pH不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用小苏打治疗胃酸过多:CO${\;}_{3}^{2-}$+2H+═CO2↑+H2O | |
| B. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | 用FeCl3溶液腐蚀印刷电路板上铜箔:Fe3++Cu═Fe2++Cu2+ | |
| D. | 钠与氢氧化钠溶液反应:2Na+2H2O═2Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑦⑧⑨⑩ | B. | ①②③⑤⑧⑨ | C. | ②⑤⑥⑦⑧ | D. | ②④⑦⑧⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 第②步反应的化学方程式为: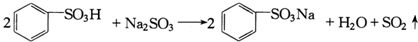 | |
| B. | 第③步反应中除了苯酚钠还会生成Na2SO4 | |
| C. | 第④步反应可表示为: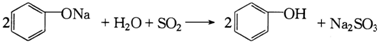 | |
| D. | 根据上述反应判断酸性强弱为: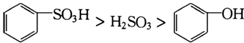 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com