
【题目】下表为元素周期表前四周期的一部分,下列是有关R、W、X、Y、Z五种元素的叙述,其中正确的是
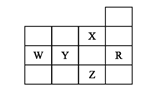
A. W元素的第一电离能小于Y元素的第一电离能
B. Y、Z的阴离子电子层结构都与R原子的相同
C. X元素是电负性最大的元素
D. p能级未成对电子最多的是Z元素
科目:高中化学 来源: 题型:
【题目】下列关于研究物质性质的基本程序,排列顺序正确是( )
a、观察物质的外观b、实验和观察c、解释及结论d、预测物质的性质.
A.bacd
B.adbc
C.abcd
D.dabc
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用12mol·L-1浓盐酸配制100mL 4.20mol·L-1稀盐酸的实验步骤如下:
①计算所需取用浓盐酸的体积 ②量取一定体积的浓盐酸 ③溶解 ④转移、洗涤 ⑤振荡 ⑥定容 ⑦摇匀 ⑧烧瓶贴标签。完成下列问题:
(1)所需取用的浓盐酸体积是 mL,量取浓盐酸所用的量筒的规格是 (从下列中选用) A.10mL B.25mL C.50mL D.100mL
(2)第⑥步实验的操作是 。
(3)下列情况对所配制的浓盐酸有何影响?(用“偏大”“偏小”“无影响”填写)
A.所用的浓盐酸长时间放置在密封不好的容器中 ;
B.容量瓶用蒸馏水洗涤后残留少量的水 ;
C.量完溶液,洗涤量筒,并将洗涤液转入容量瓶 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.凡含碳元素的化合物都是有机化合物
B.烃是指仅含碳和氢两种元素的有机物
C.烃是指燃烧后生成二氧化碳和水的有机物
D.所有的有机物均难溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铁在现代生产和生活中应用广泛。某化学研究性学习小组模拟工业生产流程制备无水氯化铁并对产物做了如下探究实验。

经查阅资料得知:①无水氯化铁在空气中易潮解,加热易升华;②工业上,向500—600℃的铁屑中通入氯气可生产无水氯化铁;③向炽热铁屑中通入氯化氢可以生产无水氯化亚铁和氢气。
请回答下列问题:
(1)装置的连接顺序为_______________(用a、b、c…h表示)。
(2)若缺少装置E对本实验造成的影响是________________________。
(3)工业生产中,会将D中干燥剂换成无水氯化钙,通过D后产生的过量氯气再用氯化亚铁溶液吸收,得到氯化铁溶液作为副产品。氯化亚铁溶液因吸收C12失去作用而失效,下列试剂中能够检验氯化亚铁溶液是否完全失效的是_______________。
a.硫氰酸钾溶液 b.铁氰化钾溶液 c.高锰酸钾溶液 d.烧碱溶液
(4)实验结束并冷却后,将硬质玻璃管及收集器中的物质一并快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:

淡红色溶液中加入过量H2O2后溶液红色加深的原因是___________________(用离子方程式表示)。
已知红色褪去的同时有气体生成,经检验为O2。该小组对红色褪去的原因进行探究。

根据实验现象判断,以下说法正确的是_________________________。(填标号)
a.实验I说明是SCN发生了反应而不是Fe3+发生反应
b.实验I说明是Fe3+发生了反应而不是SCN-发生反应
c.实验I中第3份溶液中生成的白色沉淀为BaSO3
d.实验Ⅱ排除H2O2分解产生的O2氧化SCN-的可能
由实验I和Ⅱ得出结论为_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从实验室加热氯酸钾与MnO2的混合物制氧气后的剩余物中回收二氧化锰的操作顺序正确的是
A.溶解、过滤、蒸发、洗涤 B、溶解、过滤、洗涤、干燥
C.溶解、蒸发、洗涤、过滤、 D.溶解、洗涤、过滤、干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应A(g)+2B(g)![]() C(g)+D(g)已达到平衡状态的是( )
C(g)+D(g)已达到平衡状态的是( )
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度 ④混合气体的总物质的量 ⑤混合气体的平均相对分子质量 ⑥v(C)与v(D)的比值 ⑦混合气体的总质量
A.②③④⑤⑥⑦ B.①③④⑤ C.①②③④⑤⑦ D.①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X,Y,Z 3种元素位于周期表中的同一周期,它们的最高价氧化物分别为酸性氧化物、碱性氧化物和两性氧化物,则3种元素的原子序数的大小顺序是( )
A.X>Y>Z
B.Y>Z>X
C.X>Z>Y
D.Z>X>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是
A.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热为2×(-57.3)kJ/mol
B.500℃、30MPa下,将0.5molN2和1.5mol H2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H=-38.6kJ·mol-1
2NH3(g) △H=-38.6kJ·mol-1
C.CO(g)的燃烧热是283.0 kJ/mol,则表示CO燃烧热的热化学方程式为CO(g)+1/2O2(g)=CO2 (g);△H=-283.0 kJ/mol
D.需要加热才能发生的反应一定是吸热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com