
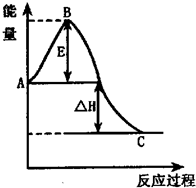
(1)已知热化学方程式如下:N2(g)+3H2O(1)==2NH3(g)+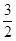 O2(g);△H="+765.2" kJ·mol-1,请在答题卡的坐标图中,画出上述反应过程中体系能量变化示意图,并进行必要标注。
O2(g);△H="+765.2" kJ·mol-1,请在答题卡的坐标图中,画出上述反应过程中体系能量变化示意图,并进行必要标注。
(2)明矾能净水的原因: (用离子方程式和必要的文字解释)
___________________________________________________________________________。
(3)已知FeCl3能水解 ,则配制FeCl3溶液的方法是 ____ 。
(4)炒过菜的铁锅未及时洗净,不久便会因腐蚀而出现红褐色锈斑。请回答:
铁锅的锈蚀是 腐蚀(填“析氢”或“吸氧”)
写出铁锅腐蚀负极的电极反应式:
正极的电极反应式:
(1)  (2分);
(2分);
(2)因为明矾溶于水发生Al3++3H2O Al(OH)3+3H+,生成Al(OH)3胶体能吸附水中的悬浮物质。(2分)
Al(OH)3+3H+,生成Al(OH)3胶体能吸附水中的悬浮物质。(2分)
(3)将FeCl3固体溶解在浓盐酸中,再加水稀释至所需浓度。(2分)
(4)吸氧腐蚀(1分),2Fe-4e-=2Fe2+(2分), O2 + 2H2O + 4e-= 4OH-(2分)
解析试题分析:(1)根据反应的热化学方程式可知,该反应是吸热反应,所以反应物的总能量低于生成物的总能量,则图像是(见答案)。
(2)因为明矾溶于水电离出的铝离子发生水解反应,Al3++3H2O Al(OH)3+3H+,生成Al(OH)3胶体能吸附水中的悬浮物质,所以明矾可以作为净水剂。
Al(OH)3+3H+,生成Al(OH)3胶体能吸附水中的悬浮物质,所以明矾可以作为净水剂。
(3)FeCl3能水解,溶液显酸性,所以配制FeCl3溶液的方法是将FeCl3固体溶解在浓盐酸中,再加水稀释至所需浓度。
(4)钢铁的腐蚀主要是吸氧腐蚀,其中负极是铁失去电子,电极反应式是2Fe-4e-=2Fe2+。正极是氧气得到电子,则电极反应式是O2 + 2H2O + 4e-= 4OH-。
考点:考查化学反应中的能量变化、明矾净水、氯化铁的配制以及钢铁的吸氧腐蚀
点评:该题是高考中的常见题型,属于中等难度的试题。试题贴近高考,基础性强,侧重对学生基础知识的巩固与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和规范答题能力。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:

| ||
| 32V |
| 22.4W |
| 22.4V |
| 32W |
| 3(W-m) |
| W |
| 8(W-m) |
| 5W |
| 催化剂 |
| △ |
| 催化剂 |
| △ |
| 1 |
| 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解



| ||
| ||
| ||
| 高温高压 |
| ||
| 高温高压 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 充电 |
| 放电 |
| ||
| 高温高压 |
| 时间/min | c(N2)/mol?L-1 | c(H2)/mol?L-1 | c(NH3)/mol?L-1 |
| 0 | 0.6 | 1.8 | 0 |
| 5 | 0.48 | X | 0.24 |
| 10 | 0.26 | 0.78 | 0.68 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (2010?南昌一模)在恒温恒容的密闭容器中通入1molN2和XmolH2,发生如下反应:N2(g)+3H2(g)
(2010?南昌一模)在恒温恒容的密闭容器中通入1molN2和XmolH2,发生如下反应:N2(g)+3H2(g)| 催化剂 | 高温、高压 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 催化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com