
【题目】(1)0.5 mol CH4的质量是________,在标准状况下的体积为________。
(2)3.1 g Na2X含有Na+ 0.1 mol,则Na2X的摩尔质量为________,X的相对原子质量为________。
(3)0.6 mol的氧气与0.4 mol臭氧(O3)质量之比为________,分子个数之比为________,氧原子个数之比为________。
(4)8.5 g氢氧根离子含有的电子数目为________。
(5)14 g C2H4与C4H8的混合物所含质子的物质的量为________。
【答案】8 g11.2 L62 g/mol161∶13∶21∶15×6.02×1023(或3.01×1024)8 mol
【解析】
(1)0.5 mol甲烷的质量=0.5 mol×16 g/mol=8 g,标准状况下甲烷的体积=0.5 mol×22.4 L/mol=11.2 L;(2)1个Na2X中有2个Na+,则含有0.1 mol Na+的Na2X物质的量为0.05 mol,M=![]() =
=![]() =62 g/mol;X的相对原子质量为62-23×2=16;(3)由m=nM可知,氧气与臭氧的质量之比为(0.6 mol×32 g/mol)∶(0.4 mol×48 g/mol)=1∶1,分子数之比等于物质的量之比为0.6 mol∶0.4 mol=3∶2,氧原子个数之比为(0.6 mol×2)∶(0.4 mol×3)=1∶1;(4)一个OH-中含有10个电子,则8.5 g氢氧根离子含有的电子数目为
=62 g/mol;X的相对原子质量为62-23×2=16;(3)由m=nM可知,氧气与臭氧的质量之比为(0.6 mol×32 g/mol)∶(0.4 mol×48 g/mol)=1∶1,分子数之比等于物质的量之比为0.6 mol∶0.4 mol=3∶2,氧原子个数之比为(0.6 mol×2)∶(0.4 mol×3)=1∶1;(4)一个OH-中含有10个电子,则8.5 g氢氧根离子含有的电子数目为![]() ×10×6.02×1023 mol-1=5×6.02×1023;(5)C2H4与C4H8的最简式均为CH2,14 g C2H4与C4H8的混合物中含有CH2部分的物质的量为
×10×6.02×1023 mol-1=5×6.02×1023;(5)C2H4与C4H8的最简式均为CH2,14 g C2H4与C4H8的混合物中含有CH2部分的物质的量为![]() =1 mol,所含质子的物质的量为1 mol×8=8 mol。
=1 mol,所含质子的物质的量为1 mol×8=8 mol。


科目:高中化学 来源: 题型:
【题目】乙醇是重要的化工原料和液体燃料,可以利用下列反应制取乙醇:2CO2(g) + 6H2(g) ![]() CH3CH2OH(g) + 3H2O(g)
CH3CH2OH(g) + 3H2O(g)
(1)写出该反应的平衡常数表达式:K=_________________________。
(2)请说明以CO2为原料合成乙醇的优点是_____________________(只要求写出一条)。
(3)在一定压强下,测得该反应的实验数据如下表:
| 500 | 600 | 700 | 800 |
1.5 | 45 | 33 | 20 | 12 |
2.0 | 60 | 43 | 28 | 15 |
3.0 | 83 | 62 | 37 | 22 |
① 该反应是___________反应(填“吸热”或“放热”)。
② 一定条件下,若提高氢碳比[n(H2)/n(CO2)],则CO2的转化率______________(填“增大”、“减小”、或“不变”)
(4)一种乙醇燃料电池中发生的化学反应为:在酸性溶液中乙醇与氧作用生成水和二氧
化碳。该电池的负极反应式为:_______________________________________。
(5)25℃、101 kPa下,H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是285.8 kJ · mol-1、1411.0 kJ · mol-1和1366.8 kJ · mol-1,请写出由C2H4(g)和H2O(l)反应生成C2H5OH(l)的热化学方程式____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有①甲烷、②乙烯、③苯、④乙酸、⑤葡萄糖5种有机物,请用序号或按题中要求作答:
(1)分子中所有原子一定都共面的是________。
(2)含氢量最高的有机化合物是________,其电子式为________。
(3)完全燃烧后生成的CO2和水的物质的量之比为1∶1的化合物是________。
(4)其中含有两种不同官能团的有机物是________,官能团的名称分别为________和________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稀氨水中存在着下列平衡:NH3·H2O![]() NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)
NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)
增大,应加入的物质或采取的措施是
①NH4Cl固体,②硫酸,③NaOH固体,④水,⑤加热,⑥加入少量MgSO4固体
A、①②③⑤ B、③ C、③⑥ D、③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列说法正确的是( )
①标准状况下,11.2 L以任意比例混合的氮气和氧气所含的原子数为NA
②同温同压下,体积相同的氢气和氩气所含的分子数相等
③1 L 2 mol·L-1的AlCl3溶液中含氯离子为6NA
④标准状况下,22.4 L H2O中分子数为NA
⑤32 g O2和O3混合气体中含有原子数为2NA
A. ①②③⑤ B. ①②③④
C. ①③④ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有0.1 mol/L的盐酸(a)、硫酸溶液(b)、醋酸溶液(c)各50 mL,试比较:
(1)三种酸的氢离子浓度由大到小的顺序是_________;三种酸的pH由大到小的顺序是______(填字母代号,下同)。
(2)三种酸跟足量的锌反应,开始时产生H2的速率由大到小的顺序是____________(不考虑Zn的纯度及表面积等问题)。
(3)三种酸跟足量的锌反应产生H2的体积由大到小的顺序是__________________。
(4)三种酸分别跟0.1 mol/L的NaOH溶液中和,消耗NaOH溶液的体积由大到小的顺序是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大。在如图所示的物质转化关系中,p、q、m、n分别是元素W、X、Y、Z的气体单质,p和s均为有色气体,v的水溶液呈碱性。常温下,0.1 molL-1 t溶液与0.1 molL-1 u溶液的pH 均为1。下列说法不正确的是
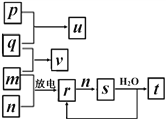
A. Y、W的最高价氧化物对应的水化物均为强酸
B. 元素的非金属性:Z>Y>X,原子半径:X<Z<Y
C. s溶于水的反应中,氧化剂与还原剂的物质的量之比为1:2
D. v的电子式可表示为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 X、Y、Z、W的原子序数依次增大,四种元素形成的单质依次为m、n、p、q;r、t、u 是这些元素组成的二元化合物,其中u为葡萄酒中的抑菌成分;25 ℃,0.01 mol/L的v溶液中: 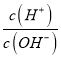 = 1.0×10-10。上述物质的转化关系如图所示,下列说法正确的是( )
= 1.0×10-10。上述物质的转化关系如图所示,下列说法正确的是( )
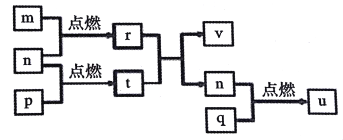
A. 简单离子半径:W>Z>Y>X
B. W,Y分別与X元素形成的简单化合物的沸点: W> Y
C. Z2Y和ZX中存在的化学键类型相同
D. v能抑制水的电离,u能促进水的电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】使用SNCR脱硝技术的原理是4NO(g)+4NH3(g)![]() 4N2(g)+6H2O(g),下图是其在密闭体系中研究反应条件对烟气脱硝效率的实验结果。下列说法正确的是( )
4N2(g)+6H2O(g),下图是其在密闭体系中研究反应条件对烟气脱硝效率的实验结果。下列说法正确的是( )
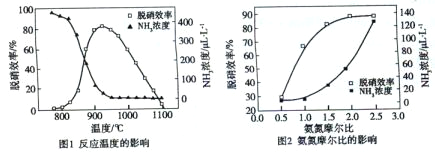
A. 从图1判断,该反应的正反应方向是放热反应
B. 从图2判断,减少氨气的浓度有助于提高NO的转化率
C. 从图1判断,脱硝的最佳温度约为 925℃
D. 从图2判断,综合考虑脱硝效率和运行成本最佳氨氮摩尔比应为2.5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com