
如下图所示25℃时,在烧杯A中装有50.0 mL水,烧杯B中装有0.50 mol?L-1盐酸50.0 mL,把NO2和N2O4的混和气体盛在两个连通的烧瓶C、D里,然后用夹子夹住橡皮管,把C烧瓶放人A烧杯中,D烧瓶放人B烧瓶中。往A烧杯中加入50.0 g NH4NO3粉末搅拌使其完全溶解,往B烧杯中加入2.0g NaOH固体搅拌并使其溶解后。回答下列问题:

![]()
(1) 烧杯B中温度(填“升高”、“降低”或“不变”)__________。
![]() (2)已知在NO2生成N2O4的可逆反应: 2NO2(g)
(2)已知在NO2生成N2O4的可逆反应: 2NO2(g) ![]() N2O4(g) △H<O,从上面实验可知C烧瓶内混和气体颜色(填“变浅”、“变深”或“不变”)______;
N2O4(g) △H<O,从上面实验可知C烧瓶内混和气体颜色(填“变浅”、“变深”或“不变”)______;
![]() (3)若实验测得B烧杯中酸碱中和反应放热1.4325 kJ,则NaOH溶液和HCl溶液发生中和反应的热化学方程式为___________。
(3)若实验测得B烧杯中酸碱中和反应放热1.4325 kJ,则NaOH溶液和HCl溶液发生中和反应的热化学方程式为___________。
![]() (4)若起始时在D烧瓶中充人m g N2O4,此时测得烧瓶中压强为1.01×105Pa,当可逆反应:N2O4(g)
(4)若起始时在D烧瓶中充人m g N2O4,此时测得烧瓶中压强为1.01×105Pa,当可逆反应:N2O4(g) ![]() 2NO2达到化学平衡状态时压强变为1.515×105Pa,则平衡混和气体的平均相对分子质量为:__________________。(精确到小数点后两位)
2NO2达到化学平衡状态时压强变为1.515×105Pa,则平衡混和气体的平均相对分子质量为:__________________。(精确到小数点后两位)
![]()
![]()
![]()
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
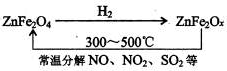
查看答案和解析>>
科目:高中化学 来源: 题型:
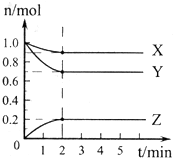 (1)某温度下,在一密闭容器中,X、Y、Z 三种气体的物质的量随时间的变化曲线如下图所示.分析有关数据,写出X、Y、Z反应的化学方程式
(1)某温度下,在一密闭容器中,X、Y、Z 三种气体的物质的量随时间的变化曲线如下图所示.分析有关数据,写出X、Y、Z反应的化学方程式查看答案和解析>>
科目:高中化学 来源: 题型:
 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如下图所示(图中的△H表示生成1mol产物的数据).
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如下图所示(图中的△H表示生成1mol产物的数据).| 3 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
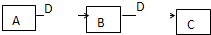 (2009?潍坊一模)A、B、C、D都是中学化学常见的物质,其中A、B、C均含同一种元素.在一定条件下相互转化关系如下图所示(部分产物已略去).请按要求回答下列问题:
(2009?潍坊一模)A、B、C、D都是中学化学常见的物质,其中A、B、C均含同一种元素.在一定条件下相互转化关系如下图所示(部分产物已略去).请按要求回答下列问题:| 催化剂 |
| 加热 |
| 催化剂 |
| 加热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com