
【题目】草酸是草本植物常具有的成分。查阅相关资料得到草酸晶体(H2C2O4·3H2O)及其盐的性质如表。
熔沸点 | 颜色与溶解性 | 部分化学性质 | 盐 |
熔点:101-102℃ 沸点:150-160℃升华 | 草酸晶体无色,易溶于水 | 100.1℃受热脱水,175℃以上分解成气体;具有还原性 | 草酸钙盐难溶于水 |
(1)草酸晶体(H2C2O4·3H2O)175℃以上会发生分解生成三种氧化物,某实验小组欲通过实验证明这三种氧化物。
①该小组选用装置丙作为分解装置,不选用甲装置的原因是_______。丙装置相对于乙装置的优点是________。实验前检验该装置气密性的操作方法是________。
甲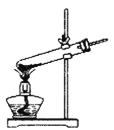 乙
乙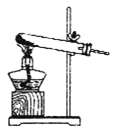 丙
丙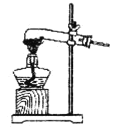
②从图中选用合适的装置,验证分解产生的气体,装置的连接顺序是______________。(用装置编号表示,某些装置可以重复使用,也可以装不同的试剂)
B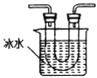 C
C D
D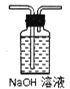 E
E![]() F
F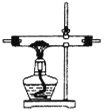
③B装置的作用是__________。
(2)某实验小组称取4.0g粗草酸晶体配成100mL溶液,采用0.1mol·L-1酸性高锰酸钾溶液滴定该草酸溶液,测定该草酸晶体的纯度。
①配制草酸溶液需要用到的主要玻璃仪器有_______________。
②本实验达到滴定终点的标志是___________。
③将所配草酸分为四等份,实验测得每份平均消耗酸性高锰酸钾溶液20mL。计算该粗草酸中含草酸晶体的质量为_______g(保留两位有效数字)。
【答案】甲装置管口向上,反应时生成的水蒸气冷凝回流易使试管炸裂 乙装置直接管口向下,晶体熔化成液态后会流出试管,而丙装置会避免这种情况发生 将丙装置导气管插入水中,加热,若导气管冒气泡,撤灯后回流一段水柱,证明装置气密性良好 EBCDCEFC 冷凝草酸,防止生成白色草酸钙沉淀干扰CO2的检验 烧杯、玻璃棒、容量瓶、胶头滴管 最后一滴高锰酸钾滴入,溶液突然无色变到粉红色(或淡红色)且半分钟内颜色不变 2.9
【解析】
(1)①该小组选用装置丙作为分解装置,不选用甲装置的原因是甲装置管口向上,反应时生成的水蒸气冷凝回流易使试管炸裂,乙装置直接管口向下,晶体熔化后液态后会流出试管,而丙装置会避免这种情况发生。根据热胀冷缩的原理,实验前检验该装置气密性的操作方法是将丙装置导气管插入水中,加热,若导气管冒气泡,撤灯后回流一段水柱,证明装置气密性良好;
②草酸晶体分解生成二氧化碳,一氧化碳,水,通过E验证分解的气体中含水,再通过B装置,冷凝草酸,防止生成白色草酸钙沉淀干扰,用C检验产生的CO2,用D除去CO2,用C检验CO2是否除尽,将余下的气体通过F,用CuO与余下的气体反应,再用C检验生成的气体,装置的连接顺序是EBCDCEFC;
③B装置的作用是冷凝草酸,防止生成白色的草酸钙沉淀干扰。
(2)①配制草酸溶液需要用到的主要玻璃仪器有:烧杯、玻璃棒、100mL容量瓶、胶头滴管;
②本实验达到滴定终点的标志是:最后一滴高锰酸钾滴入,溶液突然无色变到粉红色(或淡红色)且半分钟内颜色不变;
③将所配草酸分成四等份,实验测得每份平均消耗酸性高锰酸钾溶液20mL。滴定时酸性高锰酸钾溶液能氧化H2C2O4,生成CO2气体,同时本身被还原为Mn2+,发生反应的离子方程式为2MnO4- + 5H2C2O4 + 6H+=2Mn2+ + 10CO2↑+ 8H2O,可得关系式:5H2C2O4·3H2O~2MnO4-,m(H2C2O4·3H2O)=![]() 。
。


科目:高中化学 来源: 题型:
【题目】滴定是分析化学中最要的分析方法之一,根据其原理回答下列问题:
I、酸碱中和滴定是最基本的滴定方法:
(1)滴定管是酸碱中和滴定中重要的仪器,向25mL碱式滴定管中加入氢氧化钠溶液,开始时滴定管的读数为10.00mL,将滴定管中的液体全部放出,放出氢氧化钠溶液的体积为____________(填“大于”、“小于”或“等于”)15.00mL。
(2)向碱式滴定管中注入标准的氢氧化钠溶液之前的一步操作为(_______________)
(3)准确移取20.00 mL某待测HCl溶液于锥形瓶中,用0.1000 mol/LNaOH溶液滴定。下列说法正确的是(______)
A.锥形瓶用蒸馏水洗涤后,用待测HCl溶液润洗
B.随着NaOH溶液滴入,锥形瓶中溶液pH由小变大
C.用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定
D.滴定达终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏大
II、氧化还原滴定也是分析化学中常用的分析手段,用氧化还原滴定方法测定粗品中Na2S2O35H2O的质量分数。
实验步骤:称取6g粗品配制250mL的溶液待用。用酸式滴定管取25.00mL0.01mol/L K2Cr2O7溶液于锥形瓶中,然后加入过量的KI溶液并酸化,加几滴淀粉溶液,立即用配制的Na2S2O3溶液滴定至终点(反应为I2+2S2O32-=2I﹣+S4O62﹣),消耗Na2S2O3溶液25.00mL。回答下列问题:
(1)向K2Cr2O7溶液中加入过量的KI溶液并酸化,Cr2O72-被还原成Cr3+,写出该反应的离子方程式_____。
(2)用Na2S2O3溶液滴定至终点的现象为_________________________。
(3)粗品中Na2S2O35H2O的质量分数为___________________。
(4)若在取K2Cr2O7溶液时有部分溶液滴到了锥形瓶外,则测定结果偏_________(填“高”、“低”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸苯甲酯具有类似茉莉花香的气味,可以用甲苯和乙醇进行人工合成,其合成路线如图:
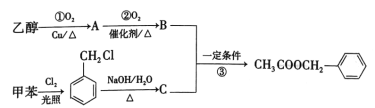
(1)写出反应①的化学方程式:___。
(2)反应③的反应类型为___。
(3)反应__(填序号)的原子利用率为100%,符合绿色化学的要求。
(4)C的结构简式为__,试写出C的另外两种不同类别的芳香类同分异构体的结构简式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧印刷电路板是一种电子废弃物,某科研小组设计如下工艺流程回收铜并制取胆矾(流程中RH为萃取剂),下列说法正确的是
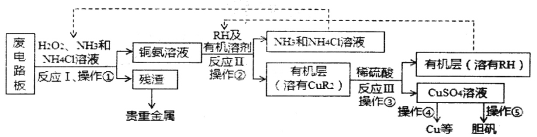
A.反应I的离子方程式为:Cu+H2O+2NH3+2NH4+==Cu(NH3)42++2H2O
B.操作②用到的主要仪器为蒸馏烧瓶
C.操作④以石墨为电极电解硫酸铜溶液:阳极产物为O2和H2SO4
D.操作⑤为:蒸发浓缩、冷却结晶、过滤、热水洗涤、干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物在现代生产和生活中发挥重要作用。
(1)可以通过热化学循环在较低温度下由硫化氢分解制备氢气。
SO2(g)+I2(s)+2H2O(1)==2HI(aq)+H2SO4(aq) △H1=—151.5kJ·mol-1
2HI(aq)==H2(g)+I2(s) △H2=+110kJ·mol-1
H2S(g)+H2SO4(aq)==S(s)+SO2(g)+2H2O(I) △H3=+65kJ·mol-1
热化学硫碘循环硫化氢分解联产氢气、硫磺的热化学方程式为_________________。
(2)硫酸厂尾气中含有大量SO2,为提高其利用率可用图1所示装置(电极均为惰性电极)将其吸收,而锂—磺酰氯(Li—SO2C12)电池可作为电源电解制备Ni(H2PO2)2(图2)。已知电池反应为:2Li+SO2C12=2LiCl+SO2↑
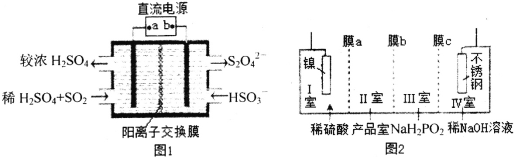
①图1中:a为直流电源的______极(填“负”或“正”),其阴极的电极反应式为_____。
②SO2C12分子中S原子的杂化方式为____________________。
③锂—磺酰氯电池的正极反应式为_______________________。
④图2中膜a为______交换膜(填“阳离子”或“阴离子”下同),膜c为_________交换膜。不锈钢电极的电极反应式为_______________________________。
(3)二氧化硫的催化氧化是工业上生产硫酸的主要反应O2(g)+2SO2(g) ![]() 2SO3(g)。
2SO3(g)。
已知:标准平衡常数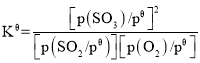 ,其中
,其中![]() 为标准压强(1×105Pa),p(SO3)、p(O2)和p(SO2)为各组分的平衡分压,如p(SO3)=x(SO3)p,p为平衡总压,x(SO3)为平衡系统中SO3的物质的量分数。SO2和O2起始物质的量之比为2:1,反应在恒定温度和标准压强下进行,SO3的平衡产率为
为标准压强(1×105Pa),p(SO3)、p(O2)和p(SO2)为各组分的平衡分压,如p(SO3)=x(SO3)p,p为平衡总压,x(SO3)为平衡系统中SO3的物质的量分数。SO2和O2起始物质的量之比为2:1,反应在恒定温度和标准压强下进行,SO3的平衡产率为![]() ,则
,则![]() _______(用含
_______(用含![]() 的最简式表示)。
的最简式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一瓶澄清的溶液,其中可能含H+、![]() 、K+、Al3+、Cu2+、Fe3+、
、K+、Al3+、Cu2+、Fe3+、![]() 、I- 中的一种或几种,取该溶液进行如下实验:
、I- 中的一种或几种,取该溶液进行如下实验:
①用pH试纸检验,表明溶液呈强酸性。
②取部分溶液,加入数滴新制的氯水及少量的CC14,振荡后CC14层显紫色。
③另取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程中有白色沉淀生产,后白色沉淀完全消失。
④将③得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
根据上述实验事实回答:
(1) 在溶液中,肯定存在的离子有_______,肯定不存在的离子有______ 。
(2) 不能确定是否存在的离子有______。证明它(们)是否存在的实验方法是______。
(3)写出步骤②涉及的离子方程式,并用单线桥标出电子转移的方向和数目______ 。
(4)写出步骤④涉及的离子方程式 ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸橙花酯是一种食用香料,结构如图所示.下列关于该有机物的说法有如下几种:
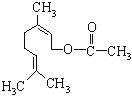
①该有机物有一种同分异构体属于酚类;
②该有机物属于酯类;
③该有机物不能发生银镜反应;
④该有机物的分子式为C11H18O2;
⑤1mol该有机物最多能与1mol NaOH反应
其中正确的是
A.①③④B.②③⑤C.①④⑤D.①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.将AlCl3溶液和Al2(SO4)3溶液分别加热、蒸干、灼烧,所得固体成分相同
B.洗涤油污常用热的纯碱溶液
C.用加热的方法可以除去KCl溶液中的Fe3+
D.配制FeSO4溶液时,将FeSO4固体溶于稀盐酸中,然后稀释至所需浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含碳碳双键的一氯丁烯(C4H7C1)的同分异构体只有8种,某学生却写了如下10种:
A.![]() ,B.
,B.![]() ,C.
,C.![]() ,D.
,D.![]() ,E.
,E.![]() ,F.
,F.![]() ,G.
,G.![]() ,H.
,H.![]() ,I.
,I.![]() ,J.
,J.![]() 。
。
其中,属于同一种物质的有________(填号,下同)和________,________和________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com