
【题目】已知下列两个反应:
① 3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O
②3Cu2S + 22HNO3 = 6Cu(NO3)2 + 3H2SO4 + 10NO↑ + 8H2O
试回答下列问题:
(1)反应①中___________(填化学式)作氧化剂;Cu发生__________(填“氧化”或“还原”)反应;用双线桥表示出反应①的电子转移方向和数目______。
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O
(2)将反应②改写为离子方程式__________________________(提示:Cu2S不溶于水)
(3)反应②中Cu2S中Cu的化合价为______;___________(填元素符号)元素被氧化,还原产物为_____________。
(4)当反应②中生成2.24L(标准状况下)NO气体,消耗HNO3的质量为__________g,其中有_________mol HNO3被还原,共转移电子_________mol。
【答案】HNO3 氧化  3Cu2S + 16H++10NO3 - = 6Cu2+ + 3SO4 2-+ 10NO↑ + 8H2O +1 Cu、S NO 13.86 0.1 0.3
3Cu2S + 16H++10NO3 - = 6Cu2+ + 3SO4 2-+ 10NO↑ + 8H2O +1 Cu、S NO 13.86 0.1 0.3
【解析】
(1)根据化合价变化分析反应①中氧化剂、还原剂、被氧化、被还原及电子得失情况;
(2)根据离子方程式的书写原则写出反应②的离子方程式;
(3)根据化合价代数和为零分析Cu2S中Cu的化合价;根据化合价变化分析反应②中氧化剂、还原剂、氧化产物、还原产物。
(4)根据反应物与生成物的化学计量关系计算反应②中有关量。
(1)反应①中,化合价升高的是铜元素,被氧化,化合价降低的元素是氮元素,所在的反应物硝酸是氧化剂,金属铜是还原剂;
化合价升高的是铜元素,化合价降低的是硝酸中的氮元素,转移电子数为6mol,双线桥法表示电子转移的方向和数目如下所示: ,
,
因此,本题正确答案是: HNO3 ;氧化; 。
。
(2)反应②中,化合价升高的是铜元素和硫元素,被氧化,化合价降低的元素是氮元素,所在的反应物硝酸是氧化剂,改成离子方程式为:3Cu2S+16H++10NO3 - = 6Cu2+ + 3SO42-+ 10NO↑+8H2O;
因此,本题正确答案是:3Cu2S + 16H++10NO3 - = 6Cu2+ + 3SO4 2-+ 10NO↑ + 8H2O。
(3)Cu2S中S为-2价,则Cu的化合价为+1;Cu、S元素化合价均升高,被氧化,硝酸是氧化剂,被还原,生成NO,还原产物为NO。
因此,本题正确答案是:+1; Cu、S; NO。
(4)由题给条件可知,生成NO的物质的量为![]() =0.1mol,
=0.1mol,
根据反应式3Cu2S + 22HNO3 = 6Cu(NO3)2 + 3H2SO4 + 10NO↑ + 8H2O,消耗HNO3的质量为0.1mol×![]() 63g/mol=13.86g;
63g/mol=13.86g;
每生成1molNO还原1mol硝酸,所以生成0.1molNO时,有0.1mol HNO3被还原,共转移0.1mol![]() 3=0.3mol电子。
3=0.3mol电子。
因此,本题正确答案是:13.86 ;0.1 ;0.3。


 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
【题目】相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:2SO3(g)![]() 2SO2(g)+O2(g)△H=+197kJ/mol。实验测得起始、平衡时的有关数据如下表:
2SO2(g)+O2(g)△H=+197kJ/mol。实验测得起始、平衡时的有关数据如下表:
容器编号 | 起始时各物质物 质 的量 /mol | 平衡时反应中的能量变化 | ||
SO3 | SO2 | O2 | ||
① | 2 | 0 | 0 | 吸收热量akJ |
② | 0 | 2 | 1 | 放出热 量 bkJ |
③ | 4 | 0 | 0 | 吸收热量ckJ |
下列叙述正确的是( )
A. 达平衡时O2的体积分数:①>③
B. 热量关系:a一定等于b
C. ①②③ 反应的平衡常数:③>①>②
D. ①中的密度不再改变时说明反应已达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于溶液的下列说法不正确的是( )
A. 某温度下,Ba(OH)2溶液中Kw=10-12,向pH=8的该溶液中加入等体积pH=4的盐酸,充分反应后,混合溶液的pH=6
B. 水电离出来的c(H+)=10-13mol/L的溶液中K+、Cl-、NO3-、I-可能大量存在
C. 往0.1mol/LNH4Cl溶液中不断加入NaOH固体,随着NaOH的加入, 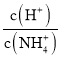 不断减小
不断减小
D. 一定温度下,氢氧化钙达到溶解平衡,向此溶液中加入少量氧化钙粉末(不考虑热效应),则溶液中c(Ca2+)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图甲是一种利用微生物将废水中的尿素(H2NCONH2)直接转化为对环境友好物质的原电池装置。现利用甲装置产生的电能对乙装置中的饱和食盐水进行电解(A、B皆为石墨电极)。下列说法中不正确的是( )

①M电极反应式:H2NCONH2+H2O+6e-=CO2↑+N2↑+6H+
②当A电极产生11.2mL气体(标况)时,则N电极消耗25×10-4mol气体
③甲中H+透过质子交换膜由右向左移动
④A电极应与X相连接
⑤反应一段时间后,乙装置U型管中的溶液pH变大
A. ①③ B. ①③⑤ C. ①②③ D. ②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校课外活动小组为测定已部分脱水的生石膏的组成(xCaSO4·yH2O),做如下实验:将固体加热,测量剩余固体的质量随时间的变化关系,如图所示。
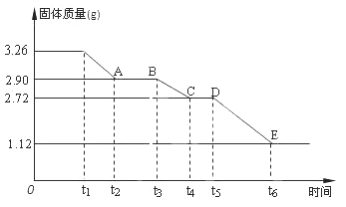
(1)t5~ t6时间段固体质量减轻的原因是产生了两种气体,其中一种能使品红溶液褪色的气体物质的量是_______________________;
(2)x∶y=________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 氧化还原反应一定属于四大基本反应类型
B. 氧化还原反应中,反应物不是氧化剂就是还原剂
C. 在氧化还原反应中,氧化剂和还原剂既可以是不同物质也可以是同种物质
D. 失电子越多,还原性越强,得电子越多,氧化性越强
查看答案和解析>>
科目:高中化学 来源: 题型:
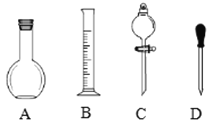
【题目】
(1)在图所示仪器中,配制上述溶液肯定不需要的是______(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是______.
(2)在容量瓶的使用方法中,下列操作不正确的是______
A.使用容量瓶前检验是否漏水 |
B.容量瓶用水洗净后,再用待配溶液洗涤 |
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线. |
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线. |
E.盖好瓶塞,用食指顶住瓶塞,另一只手的手指托住瓶底,把容量瓶反复倒转多次,摇匀.
(3)根据计算用托盘天平称取NaOH固体的质量为______g.在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度______0.1mol/L(填“大于”“小于”或“等于”).
(4)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为______mL,如果实验室有15mL、20mL、50mL量筒,应选用______mL量筒最好.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com