解答:解:Q、X、W、Y、Z都是元素周期表中前36号的元素,处于前四周期,其中X、W同周期,Q、W同主族:
①Q、W同主族,电负性Q>W,W原子序数较大,X、Y原子的价层电子构型为nS
1,处于ⅠA族,X的电负性较大,则X的原子序数较小,由于X、W同周期,可知Q处于第二周期,X、W处于第三周期,Y处于第四周期,故X为Na、Y为K;
②X、Y、Z可与W形成XW、YW、ZW化合物,则W表现-1价,YW中阳离子与阴离子电子层结构相同,则W为Cl、故Q为F元素,化合物ZW中Z表现+1价,ZW中阳离子的最外层3d轨道无单电子,则Z
+离子核外电子排布为1s
22s
22p
63s
23p
63d
10,故Z原子核外电子数为29,则Z为Cu,
(1)Q为F元素,原子核外电子数为9,原子的轨道表示式为

,
故答案为:

;
(2)NaCl、KCl都属于离子晶体,Na
+离子半径小于K
+离子半径,NaCl的晶格能大于KCl晶格能,故NaCl的熔点较高,
故答案为:熔点NaCl>KCl,原因是:Na
+离子半径小于K
+离子半径,NaCl的晶格能大于KCl晶格能;
(3)Z为Cu元素,核外电子排布为1s
22s
22p
63s
23p
63d
104s
1,价层电子排布式为3d
104s
1;灼烧化合物CuCl
2火焰发出绿色的光,燃烧时,铜离子中的基态电子获得能量,从内层轨道跃迁到外层另一轨道,跃迁到新轨道的电子处于一种不稳定状态,它随即会跳回到原轨道,并向外界释放能量(光能)而发光,
故答案为:3d
104s
1;燃烧时,铜离子中的基态电子获得能量,从内层轨道跃迁到外层另一轨道,跃迁到新轨道的电子处于一种不稳定状态,它随即会跳回到原轨道,并向外界释放能量(光能)而发光;
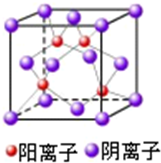
(4)由CuCl的晶胞结构可知,与Cl
-离子周围最近的阳离子有4个,构成四面体结构;CuCl晶胞中Cu原子数目为4,Cl原子数目为4个,则晶胞的质量为
| 4×99.5g?mol-1 |
| 6.02×1023mol-1 |
,晶体的密度为a g?cm
-3,则晶胞的体积=
| 4×99.5g?mol-1 | | 6.02×1023mol-1 |
|
| ag?cm-3 |
=
| 4×99.5g?mol-1 |
| ag?cm-3×6.02×1023mol-1 |
,
故答案为:4;
| 4×99.5g?mol-1 |
| ag?cm-3×6.02×1023mol-1 |
;
(5)Q的气态氢化物为HF,由于HF分子之间通过氢键结合成(HF)
n,温度越高氢键破坏程度越大,HF聚合程度越小,测量的摩尔质量越接近HF,故不同温度下测量HF的摩尔质量不同,
故答案为:由于HF分子之间通过氢键结合成(HF)
n,温度越高氢键破坏程度越大,HF聚合程度越小,测量的摩尔质量越接近HF.

 ,
, ;
;

 名校课堂系列答案
名校课堂系列答案