
科目:高中化学 来源: 题型:阅读理解


| 高温高压 |
| 催化剂 |
| 高温高压 |
| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
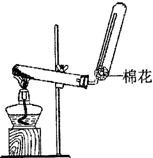 (2010?崇文区二模)X、Y、Z、W均为含有10电子的微粒,其中X、Y、Z为分子,W为离子,且X与Z分子中含有的共用电子对数之比为3:4.
(2010?崇文区二模)X、Y、Z、W均为含有10电子的微粒,其中X、Y、Z为分子,W为离子,且X与Z分子中含有的共用电子对数之比为3:4.

| ||
| ||
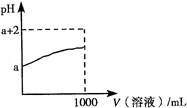
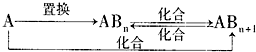
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解



| ||
| ||

查看答案和解析>>
科目:高中化学 来源:江苏省金陵中学河西分校2009届高三化学月考试卷人教版 人教版 题型:022
已知氨分子内键与键的夹角约为107°1![]() .从反应NH3+H+→NH
.从反应NH3+H+→NH![]() 可知:NH
可知:NH![]() 中有一根键比较特殊,其结构如下图a所示.但是,虽然有一根键形成过程与众不同,而其结果是完全相同的,都是N、H原子间共用一对电子,键与键的夹角均为109°2
中有一根键比较特殊,其结构如下图a所示.但是,虽然有一根键形成过程与众不同,而其结果是完全相同的,都是N、H原子间共用一对电子,键与键的夹角均为109°2![]() .故NH
.故NH![]() 的结构如图b所示.
的结构如图b所示.
还有一些你熟悉的分子或离子中,也存在上述特殊共价键,如:________等.(在下列微粒中选择填空:[Ag(NH3)2]+,PCl5,Fe(SCN)3,NH3·H2O,H3O+)

查看答案和解析>>
科目:高中化学 来源:2007届高三第一次月考(化学)人教 人教 题型:022
Ⅰ右图中A、B、C、D四条曲线是表示ⅣA、ⅤA、ⅥA、ⅦA族元素的气态氢化物的沸点变化曲线,其中A、D分别表示________、________族元素气态氢

化物的沸点变化;同一族中第3、4、5周期元素的气态氢化物沸点依次升高,其原因是________;
图中第2周期有三种元素的气态氢化物沸点显著高于相应的同族第3周期元素气态氢化物的沸点,其原因是________
Ⅱ.已知氨分子内键与键的夹角约为107o18’.从反应NH3+H+→NH4+可知:NH4+中有一根键比较特殊,其结构可表示为A式.但是,虽然有一根键形成过程与众不同,而其结果是完全相同的,都是N、H原子间共用一对电子,键与键的夹角均为109o28’.故NH4+的结构也可表示为B式.

(1)还有一些你熟悉的分子或离子中,也存在上述特殊共价键,如:________等.
(在下列微粒中选择填空:[Ag(NH3)2]+,PCl5,Fe(SCN)3,NH3·H2O,H3O+)
(2)写出H3O+的电子式________;你认为H3O+中键与键的夹角与下列哪个角度最接近?________
A、120o
B、109o28'
C、107o18'
D、60o
(3)氮化硼(BN)是一种新型无机非金属材料,它有两种晶型:金刚石晶型和石墨晶型.其中,金刚石晶型的氮化硼材料具有硬度大、熔点高等特性,它的结构中也含有上述特殊共价键.则:在金刚石晶型的氮化硼中,每个硼原子与________个氮原子以B─N键连接,原子间相互连接的最小的环上有________个氮原子和________个硼原子.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com