
科目:高中化学 来源: 题型:
 (2010?山东)硫一碘循环分解水制氢主要涉及下列反应:
(2010?山东)硫一碘循环分解水制氢主要涉及下列反应: H2+I2
H2+I2 2HI(g)的平衡常数K=
2HI(g)的平衡常数K=查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
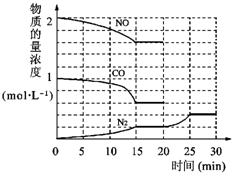 环境问题备受世界关注.化工厂以及汽车尾气排放的一氧化碳(CO)、氮氧化物(NOx)、硫化物等气体己成为大气污染的主要因素.
环境问题备受世界关注.化工厂以及汽车尾气排放的一氧化碳(CO)、氮氧化物(NOx)、硫化物等气体己成为大气污染的主要因素. O2+Hb?CO
O2+Hb?CO N2(g)+2CO2(g)△H=-113kJ?mol-1
N2(g)+2CO2(g)△H=-113kJ?mol-1| 0.4 |
| 15 |
| 0.4 |
| 15 |
 H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
| A | B | C | D | |
| n(CO2) | 3 | 1 | 0 | 1 |
| n(H2) | 2 | 1 | 0 | 1 |
| n(CO) | 1 | 2 | 3 | 0.5 |
| n(H2O) | 5 | 2 | 3 | 2 |
查看答案和解析>>
科目:高中化学 来源:2011届广东省高三全真高考模拟(四)(理综)化学部分 题型:填空题
(16分) 硫—碘循环分解水制氢主要涉及下列反应:
I SO2+2H2O+I2==H2SO4+2HI
II 2HI  H2+I2
H2+I2
III 2H2SO4==2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是 。
a.反应III易在常温下进行
b.反应I中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程中产生1molO2的同时产生1 molH2
(2)一定温度下,向1L密闭容器中加入1molHI(g),发生反应II,H2物质的量随时间的变化如图所示。0~2min内的平均反应速率v(HI)= 。该温度下,H2(g)+I2(g) 2HI(g)的平衡常数K= 。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则 是原来的2倍。
2HI(g)的平衡常数K= 。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则 是原来的2倍。
a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡 移动(填“向左”“向右”或“不”);若加入少量下列试剂中的 ,产生H2的速率将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(4)以H2为燃料可制作氢氧燃料电池。
已知 2H2(g)+O2(g)====2H2O(l) △H=-572kJ·mol-1
某氢氧燃料电池释放22.8kJ电能时,生成1mol液态水,该电池的能量转化率为 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年广东省高三全真高考模拟(四)(理综)化学部分 题型:填空题
(16分) 硫—碘循环分解水制氢主要涉及下列反应:
I SO2+2H2O+I2==H2SO4+2HI
II 2HI  H2+I2
H2+I2
III 2H2SO4==2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是 。
a.反应III易在常温下进行
b.反应I中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程中产生1molO2的同时产生1 molH2
(2)一定温度下,向1L密闭容器中加入1molHI(g),发生反应II,H2物质的量随时间的变化如图所示。0~2min内的平均反应速率v(HI)=
。该温度下,H2(g)+I2(g) 2HI(g)的平衡常数K= 。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则
是原来的2倍。
2HI(g)的平衡常数K= 。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则
是原来的2倍。

a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡 移动(填“向左”“向右”或“不”);若加入少量下列试剂中的 ,产生H2的速率将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(4)以H2为燃料可制作氢氧燃料电池。
已知 2H2(g)+O2(g)====2H2O(l) △H=-572kJ·mol-1
某氢氧燃料电池释放22.8kJ电能时,生成1mol液态水,该电池的能量转化率为 。
查看答案和解析>>
科目:高中化学 来源:2013届山东省潍坊市高二寒假作业化学(二)试卷 题型:填空题
硫—碘循环分解水制氢主要涉及下列反应:
Ⅰ SO2+2H2O+I2===H2SO4+2HI
Ⅱ 2HI H2+I2
H2+I2
Ⅲ 2H2SO4===2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是________(填编号)。
a.反应Ⅲ易在常温下进行
b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程产生1 mol O2的同时产生1 mol H2
(2)一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。

①0~2 min内的平均反应速率v(HI)=
。该温度下,H2(g)+I2(g) 
2HI(g)的平衡常数K= 。
②相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则 是原来的2倍。
a.平衡常数
b.HI的平衡浓度
c.达到平衡的时间
d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡 移动(填“向左”“向右”或“不”);若加入少量下列试剂中的 ,产生H2的速率将增大。
a.NaNO3 b.CuSO4
c.Na2SO4 d.NaHSO3
(4)以H2为燃料可制作氢氧燃料电池。
已知2H2(g)+O2(g)===2H2O(l) ΔH=-572 kJ·mol-1,某氢氧燃料电池释放228.8 kJ电能时,生成1 mol液态水,该电池的能量转化率为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com