
| A. | 0.225 | B. | 0.30 | C. | 0.36 | D. | 0.45 |
分析 发生反应离子方程式为:3Cu+2NO3-+8H+=3Cu2++2NO(g)+4H2O,由上述反应方程式可知,NO3-和H+的物质的量之比为1:4,氢离子与硝酸根恰好反应,生成的铜离子物质的量最大;设HNO3、H2SO4各为x、ymol,则n(NO3-):n(H+)=x:(x+2y)=1:4,x+y=0.6×0.1,据此计算x、y的值,再根据方程式计算铜离子的物质的量,根据c=$\frac{n}{V}$计算铜离子浓度.
解答 解:反应的离子方程式为:3Cu+2NO3-+8H+=3Cu2++2NO(g)+4H2O,铜足量,由上述反应方程式可知,NO3-和H+的物质的量之比为1:4,氢离子与硝酸根恰好反应,生成的铜离子物质的量最大,
设HNO3、H2SO4各为x、ymol,则n(NO3-):n(H+)=x:(x+2y)=1:4、x+y=0.6×0.1,
联立解得:x=0.024mol、y=0.036mol,
由方程式可知,生成铜离子的物质的量为:0.024mol×$\frac{3}{2}$=0.036mol,
所以铜离子的最大浓度为:$\frac{0.036mol}{0.1L}$=0.36mol/L,
故选C.
点评 本题考查化合物的有关计算,题目难度中等,确定NO3-和H+的物质的量之比为1:4时生成的铜离子浓度最大是解题的关键,注意利用离子方程式进行解答.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

| 物质 | 沸点 |
| 乙醚 | 34.6℃ |
| 乙醇 | 78.2℃ |
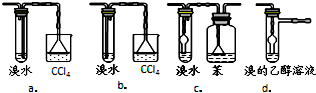

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4H与水反应时,NH4H是还原剂 | B. | NH4H溶于水时,溶液显酸性 | ||
| C. | H-的离子半径小于Li+的离子半径 | D. | NH4H中只有离子键没有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 反应前后分子种类不发生改变 | |
| B. | 反应前后原子的种类与数目发生改变 | |
| C. | 反应前两种分子的个数比是1:2 | |
| D. | 该反应的基本类型是化合反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在燃煤中加入石灰石可减少SO2排放,发生的反应为:2CaCO3=2SO2+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CO2+2CaSO4 | |
| B. | C02通入水玻璃可以得到硅酸沉淀 | |
| C. | 硅主要以单质、氧化物、硅酸盐的形式存在于自然界中 | |
| D. | 氢氟酸能够雕刻玻璃,故不能用玻璃瓶来盛装氢氟酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将CO中毒者移至通风处抢救 | |
| B. | 误食硫酸铜溶液,可服用氢氧化钠溶液解毒 | |
| C. | 浓H2SO4溅到皮肤上,立即用碳酸钠稀溶液洗涤 | |
| D. | 氢氧化钠浓溶液溅入眼中,应立即用大量水冲洗,再用稀盐酸冲洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
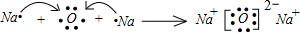 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com