
将KCl和KBr的混合物13.4 g溶于水配成500 mL溶液,通入过量的Cl2,反应后将溶液蒸干,得固体11.175 g,则原来所配溶液中K+、Cl-、Br-的物质的量浓度之比为( )
A.1∶2∶3 B.3∶2∶1
C.1∶3∶2 D.2∶3∶1
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:
依据元素周期表及元素周期律,下列推断正确的是( )
A.H3BO3的酸性比H2CO3的强
B.Mg(OH)2的碱性比Be(OH)2的强
C.HCl、HBr、HI的热稳定性依次增强
D.若M+和R2-的核外电子层结构相同,则原子序数:R>M
查看答案和解析>>
科目:高中化学 来源: 题型:
图中每一方格表示有关的一种反应物或生成物。已知B是一种单质,其余物质都是含有B元素的化合物;C是一种钠盐;E是C对应的酸;B和D的晶体都是高熔点、坚硬的固体,且D为B的氧化物(其他不含B元素的反应物以及各步反应添加的必要试剂和反应条件均被略去)。

(1)写出A、D、E的化学式:
A________________________________________________________________________;
D________________________________________________________________________;E__________________。
(2)在工业上,用碳在高温下还原D的方法可制得含少量杂质的B,其化学反应方程式为
________________________________________________________________________;
A和B的互变在工业上的实际意义是
________________________________________________________________________
________________________。
(3)写出D―→C反应的离子方程式_________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某科研小组,用含有少量的CaO和Fe2O3的高岭土(主要成分:Al2O3·2SiO2·2H2O)试验新型的净水剂。试验程序如下:

已知:Al2O3与纯碱反应的产物是Na[Al(OH)4]和CO2。试回答下列问题:
(1)写出混合物A、B、滤液C、沉淀D的主要成分:
A.__________;B.__________;C.____________;D.__________。
(2)写出高岭土与纯碱熔融的两个化学方程式______________________________,______________________________________。
(3)沉淀D的化学式是________,生成该沉淀的离子方程式为__________________。
(4)该试验中,熔融高岭土可以选用的坩埚有______。
A.玻璃坩埚 B.瓷坩埚
C.氧化铝坩埚 D.铁坩埚
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验方法中正确的是( )
A.用酒精从碘水中萃取碘
B.用加热的方法从碘和沙子的混合物中分离出碘
C.用淀粉液直接检出I-
D.根据加入AgNO3溶液产生白色沉淀的现象认定溶液中含Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应既属于氧化还原反应,又是吸热反应的是( )
A.铝片与稀盐酸的反应 B.Ca(OH)2与NH4Cl的反应
C.灼热的炭与CO2的反应 D.甲烷在氧气中的燃烧反应
查看答案和解析>>
科目:高中化学 来源: 题型:
人们常利用化学反应中的能量变化为人类服务。
(1)煤是一种重要的燃料,在点燃条件下燃烧,放出大量的热。其在燃烧过程中能量的变化与下列示意图中的________(填字母代号)最相符。
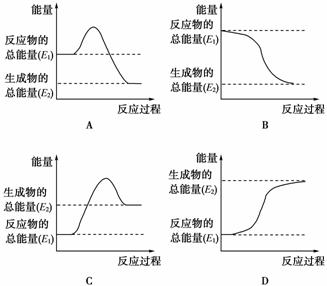
(2)将一定量的碳酸钠晶体与硝酸铵晶体密封于一塑料袋中,用线绳绑住塑料袋中间部分,使两种晶体隔开,做成“冰袋”。使用时将线绳解下,用手使袋内两种固体粉末充分混合,便立即产生低温,这种“冰袋”可用于短时间保鲜食物。则碳酸钠与硝酸铵的总能量________(填“高于”或“低于”)反应后生成产
物的总能量。
(3)化学反应中的能量变化不仅仅表现为热能的变化,有时还可以表现为其他形式的能量变化。比如,停电时,人们一般点蜡烛来照明,这是将化学能转化为________;人们普遍使用的干电池,是将化学能转化为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,用0.l00mol/L NaOH溶液分别滴定20.00 mL 0.100 mol/L的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是
A.II表示的是滴定醋酸的曲线
B.pH=7时,滴定醋酸消耗的V(NaOH)小于20 mL
C.V(NaOH)= 20.00 mL时,两份溶液中c(Cl-)= C(CH3COO-)
D.V(NaOH) =10.00 mL时,醋酸溶液中c(Na+)> C(CH3COO-)> c(H+)> c(OH-)

查看答案和解析>>
科目:高中化学 来源: 题型:
近年来,为提高能源利用率,西方提出共生理念——为提高经济效益,人类生产活动尽可能多功能化。共生工程将会大大促进化学工业的发展。
(1)由于共生工程的应用,利用发电厂产生的SO2制成自发电池,其电池反应方程式为:2SO2+O2+2H2O=2H2SO4,该电池电动势为1.06V。实际过程中,将SO2通入电池的 极
(填“正”或“负”),负极反应式为 ;用这种方法处理SO2废气的优点是
。
(2)以硫酸工业的SO2尾气、氨水、石灰石、焦炭、碳酸氢铵和氯化钾等为原料,可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质。合成路线如下:
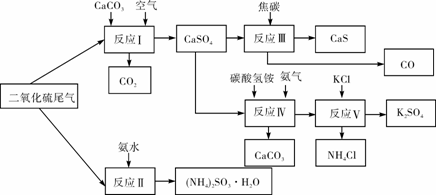
① 生产中,向反应II中的溶液中加入适量还原性很强的对苯二酚等物质,其目的是
。
② 下列有关说法正确的是 (填序号)。
A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙
B.反应III中发生反应的化学方程式为CaSO4+4C  CaS+4CO↑
CaS+4CO↑
C.反应IV需控制在60~70℃,目的之一是减少碳酸氢铵的分解
D.反应V中的副产物氯化铵可用作氮肥
 ③ 反应V中选用了40%的乙二醇溶液做溶剂,温度控制在25℃,此时硫酸钾的产率
③ 反应V中选用了40%的乙二醇溶液做溶剂,温度控制在25℃,此时硫酸钾的产率
超过90%,选用40%的乙二醇溶液做溶剂的原因是 。
④(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统。写出二氧化氮与亚硫酸铵反应的化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com