
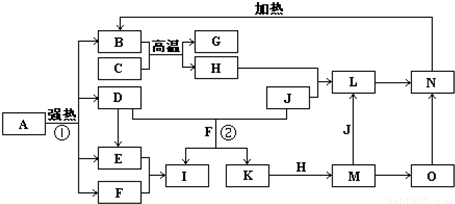
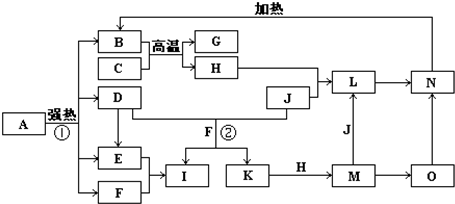
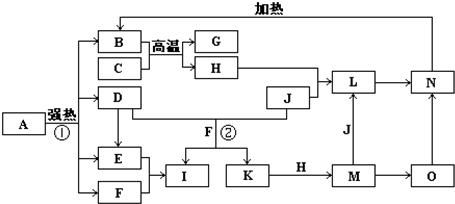
 G+H”,可联系铝热反应进行分析得H为铁,再据H+J→L、M+J→L,可进一步确认C为Al,H为Fe,G是Al2O3,M含Fe2+,L含Fe3+,O是白色沉淀且B、H、L、M、N、O中含有同种元素,证明O是Fe(OH)2,N为Fe(OH)3,B为Fe2O3,J是气态非金属单质,能发生反应和铁直接生成L,也可以利用铁和K反应生成的M和J反应生成L,所以L为FeCl3,M为FeCl2,判断K为HCl,依据转化关系中的反应,D+J(Cl2)+F(H2O)=I(H2SO4)+K(HCl),推断D为SO2;
G+H”,可联系铝热反应进行分析得H为铁,再据H+J→L、M+J→L,可进一步确认C为Al,H为Fe,G是Al2O3,M含Fe2+,L含Fe3+,O是白色沉淀且B、H、L、M、N、O中含有同种元素,证明O是Fe(OH)2,N为Fe(OH)3,B为Fe2O3,J是气态非金属单质,能发生反应和铁直接生成L,也可以利用铁和K反应生成的M和J反应生成L,所以L为FeCl3,M为FeCl2,判断K为HCl,依据转化关系中的反应,D+J(Cl2)+F(H2O)=I(H2SO4)+K(HCl),推断D为SO2; G+H”,可联系铝热反应进行分析得H为铁,再据H+J→L、M+J→L,可进一步确认C为Al,H为Fe,G是Al2O3,M含Fe2+,L含Fe3+,O是白色沉淀且B、H、L、M、N、O中含有同种元素,证明O是Fe(OH)2,N为Fe(OH)3,B为Fe2O3,J是气态非金属单质,能发生反应和铁直接生成L,也可以利用铁和K反应生成的M和J反应生成L,所以L为FeCl3,M为FeCl2,判断K为HCl,依据转化关系中的反应,D+J(Cl2)+F(H2O)=I(H2SO4)+K(HCl),推断D为SO2;I是基础化学工业的重要产品,其消费量常被视为一个国家工业发达水平的一种标志,则I是H2SO4,E为SO3,F为H2O,
G+H”,可联系铝热反应进行分析得H为铁,再据H+J→L、M+J→L,可进一步确认C为Al,H为Fe,G是Al2O3,M含Fe2+,L含Fe3+,O是白色沉淀且B、H、L、M、N、O中含有同种元素,证明O是Fe(OH)2,N为Fe(OH)3,B为Fe2O3,J是气态非金属单质,能发生反应和铁直接生成L,也可以利用铁和K反应生成的M和J反应生成L,所以L为FeCl3,M为FeCl2,判断K为HCl,依据转化关系中的反应,D+J(Cl2)+F(H2O)=I(H2SO4)+K(HCl),推断D为SO2;I是基础化学工业的重要产品,其消费量常被视为一个国家工业发达水平的一种标志,则I是H2SO4,E为SO3,F为H2O,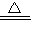 Fe2O3+SO2↑+SO3↑+14H2O,
Fe2O3+SO2↑+SO3↑+14H2O, Fe2O3+SO2↑+SO3↑+14H2O;
Fe2O3+SO2↑+SO3↑+14H2O;

 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com