
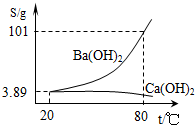
 如图为Ba(OH)2和Ca(OH)2的溶解度曲线,现有一份氢氧化钙和氢氧化钡混合溶液样品.关于该混合溶液说法错误的是( )
如图为Ba(OH)2和Ca(OH)2的溶解度曲线,现有一份氢氧化钙和氢氧化钡混合溶液样品.关于该混合溶液说法错误的是( )| A、其他条件不变,将80℃的混合液降温至20℃,其溶液中所含的Ca(OH)2的物质的量不会发生改变 | B、其他条件不变,将80℃的混合液降温至20℃,此时溶液中Ba(OH)2和Ca(OH)2的浓度相同 | C、若混合液是大量Ba(OH)2和少量Ca(OH)2组成,可以先制得80℃的浓溶液,降温结晶过滤后可获得较纯净的Ba(OH)2晶体 | D、若混合液是大量Ca(OH)2和少量Ba(OH)2组成,可以在80℃蒸发溶剂,蒸发至晶体析出后,趁热过滤获得较纯的Ca(OH)2晶体 |


科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:
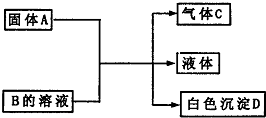 A、B、C、D为中学化学常见的物质,它们间的反应关系如图所示.
A、B、C、D为中学化学常见的物质,它们间的反应关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
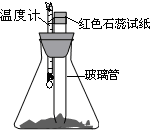 室温下将40g已磨成粉末的Ba(OH)2?8H2O和20g NH4Cl置于250mL锥形瓶中,并迅速搅拌将固体药品混合均匀(如图),再在玻璃管口悬挂一块湿润的红色石蕊试纸.请回答下列问题:
室温下将40g已磨成粉末的Ba(OH)2?8H2O和20g NH4Cl置于250mL锥形瓶中,并迅速搅拌将固体药品混合均匀(如图),再在玻璃管口悬挂一块湿润的红色石蕊试纸.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com