
| A. | 该反应是置换反应 | |
| B. | 氧化剂与还原剂的物质的量之比为3:2 | |
| C. | 氧化产物与还原产物的物质的量之比为6:1 | |
| D. | 被氧化的氨与未被氧化的氨的质量之比为1:3 |
分析 反应3Cl2+8NH3═N2+6NH4Cl中,Cl元素化合价降低,被还原,Cl2为氧化剂,6NH4Cl为还原产物,N元素化合价升高,被氧化,NH3为还原剂,N2为氧化产物,以此解答.
解答 解:A.该反应为单质和化合物生成另一单质和化合物,所以为置换反应,故A正确;
B.Cl元素化合价降低,则3Cl2为氧化剂,氮元素化合价升高,则2NH3为还原剂,所以氧化剂与还原剂的物质的量之比为3:2,故B正确;
C.Cl元素化合价降低,被还原,则6NH4Cl为还原产物,氮元素化合价升高,被氧化,则N2为氧化产物,所以氧化产物与还原产物的物质的量之比为1:6,故C错误;
D.由方程式可知,当有8molNH3参加反应,有2mol被氧化,6mol未被氧化,所以被氧化的氨与未被氧化的氨的质量之比为1:3,故D正确.
故选C.
点评 本题考查氯气的性质,侧重于化学与生活、生产的联系以及氧化还原反应的考查,注意从元素化合价的角度解答该题,难度不大.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:选择题
| A. | 100 ml 容量瓶、40 g | B. | 500 ml 容量瓶、40 g | ||
| C. | 100 ml 容量瓶、80 g | D. | 500 ml 容量瓶、80 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
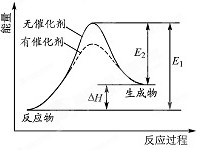 某反应的反应过程中能量变化如图所示(E1表示正反应的活化能.E2表示逆反应的活化能).下列有关叙述正确的是( )
某反应的反应过程中能量变化如图所示(E1表示正反应的活化能.E2表示逆反应的活化能).下列有关叙述正确的是( )| A. | 该反应为放热反应 | |
| B. | 催化剂能降低反应的活化能 | |
| C. | 催化剂能改变反应的焓变 | |
| D. | 逆反应的活化能大于正反应的活化能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 |
| 2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 此反应是氧化还原反应 | |
| B. | 反应瞬间产生大量高温气体,推动火箭飞行 | |
| C. | 在反应中N2O4做还原剂 | |
| D. | R的分子式为C2H8N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,下列叙述中不正确的是( )
,下列叙述中不正确的是( )| A. | 1mol胡椒粉最多可与4mol氢气发生反应 | |
| B. | 1mol胡椒粉最多可与4mol溴发生反应 | |
| C. | 胡椒粉能发生加聚反应,且能与氢氧化钠溶液反应 | |
| D. | 胡椒粉分子中所有碳原子可能在同一平面上 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com