
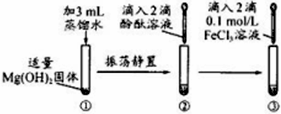
| A、试管②滴入酚酞后溶液可能变浅红 |
| B、试管③滴入FeCl3溶液后有红褐色沉淀生成 |
| C、试管③中的变化是物理变化 |
| D、上述反应说明Fe(OH)3溶解性小于Mg(OH)2 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
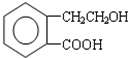 ,它可通过不同化学反应分别制得B、C和D 三种物质.
,它可通过不同化学反应分别制得B、C和D 三种物质.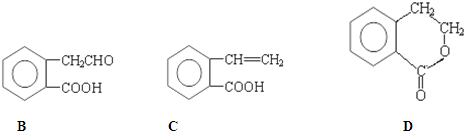
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝铵矾[NH4Al(SO4)2?12H2O]溶液中加入过量Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O |
| B、H2O2溶液中滴加酸性KMnO4溶液:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O |
| C、铁屑溶于过量稀硝酸:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O |
| D、少量NaHSO4溶液与足量Ba(OH)2溶液反应:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
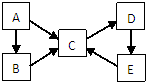 A、B、C、D、E五种物质(或离子)均含有同一种元素,它们之间有如下转化关系:
A、B、C、D、E五种物质(或离子)均含有同一种元素,它们之间有如下转化关系:查看答案和解析>>
科目:高中化学 来源: 题型:
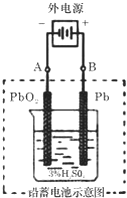
查看答案和解析>>
科目:高中化学 来源: 题型:
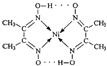 分子内的作用力除共价键外,还存在的两种作用力是
分子内的作用力除共价键外,还存在的两种作用力是 、④HCHO等,其中碳原子采取sp2杂化的分子有
、④HCHO等,其中碳原子采取sp2杂化的分子有
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com