将Na2O2、NaHCO3组成的混合物分成等质量的两份,向第一份中加入200mL盐酸,充分反应后恰好成中性,放出的气体共4.48L.将此气体通入第二份混合物中,充分反应后,气体体积变为4.032L(均为标准状况).求(1)、加入的盐酸的物质的量浓度.(2)、混合物中Na2O2与NaHCO3的物质的量之比.(写出简要过程)
【答案】
分析:根据反应的可能方程式以及气体体积的变化判断反应的可能性,根据二氧化碳是否过量用讨论的方法计算.
解答:解:发生反应的方程式有:
①2Na
2O
2+4HCl=4NaCl+2H
2O+O
2②NaHCO
3+HCl=NaCl+H
2O+CO
2③2Na
2O
2+2CO
2=2Na
2CO
3+O
2 NaHCO
3与盐酸反应产生CO
2,Na
2O
2与盐酸反应生成O
2,而CO
2与Na
2O
2反应将产生O
2,
故两步反应后的剩余气体一定有O
2,可能有CO
2,
2.24 L气体的物质的量为
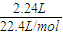
=0.1 mol,
2.016 L气体的物质的量为
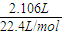
=0.09 mol,
2Na
2O
2+2CO
2=2Na
2CO
3+O
2 △n
0.02mol 0.02mol 0.01mol
n n 0.1mol-0.09mol=0.01mol
n=0.02mol,
1、若CO
2完全反应,则第一份生成CO
2的为0.02mol,O
2为0.1mol-0.02mol=0.08mol
2Na
2O
2+4HCl=4NaCl+2H
2O+O
20.16mol 0.32mol 0.08mol
NaHCO
3+HCl=NaCl+H
2O+CO
20.02mol 0.02mol 0.02mol
消耗的HCl为0.32mol+0.02mol=0.34mol
c(HCl)=
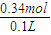
=3.4 mol/L
混合物中Na
2O
2与NaHCO
3的物质的量之比0.16mol:0.02mol=8:1;
2、若CO
2未完全反应,则Na
2O
2应是0.02 mol,
则第一份生成O
2的为0.01mol,CO
2为0.1mol-0.01mol=0.09mol
2Na
2O
2+4HCl=4NaCl+2H
2O+O
20.02mol 0.04mol 0.01mol
NaHCO
3+HCl=NaCl+H
2O+CO
20.09mol 0.09mol 0.09mol
消耗的HCl为 0.04mol+0.09mol=0.13mol
c(HCl)=
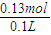
=1.3 mol/L,
混合物中Na
2O
2与NaHCO
3的物质的量之比0.02mol:0.09mol=2:9.
故答案为:(1)加入的盐酸的物质的量浓度可能为3.4 mol/L或1.3 mol/L;
(2)混合物中Na
2O
2与NaHCO
3的物质的量之比可能为8:1或2:9.
点评:本题考查混合物的计算,题目难度较大,注意用讨论的方法计算.

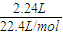 =0.1 mol,
=0.1 mol,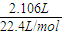 =0.09 mol,
=0.09 mol,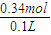 =3.4 mol/L
=3.4 mol/L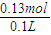 =1.3 mol/L,
=1.3 mol/L,

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案