
| A. | CS2为V形的极性分子 | B. | ClO3-的空间构型为三角锥形 | ||
| C. | SF6中有6对完全相同的成键电子对 | D. | PCl5和SO3均为非极性分子 |
分析 A.CS2 中C原子孤电子对数=$\frac{4-2×2}{2}$=0,价层电子对数=2+0=2,为直线形对称结构;
B.ClO3-中Cl原子孤电子对数=$\frac{7+1-2×3}{2}$=1,价层电子对数=3+1=4;
C.SF6中含有6个完全相同的S-F键;
D.对应ABn型分子,中心原子最外层电子全部参与成键,该分子为非极性分子.
解答 解:A.CS2 中C原子孤电子对数=$\frac{4-2×2}{2}$=0,价层电子对数=2+0=2,为直线形对称结构,属于非极性分子,故A错误;
B.ClO3-中Cl原子孤电子对数=$\frac{7+1-2×3}{2}$=1,价层电子对数=3+1=4,空间构型为三角锥形,故B正确;
C.SF6中含有6个S-F键,化学键完全相同,故C正确;
D.PCl5和SO3电子中P、S原子最外层电子全部参与成键,均为非极性分子,故D正确.
故选:A.
点评 本题考查微粒空间构型判断、分子极性、化学键等,区别分子极性与化学键极性,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| A | 第二周期中形成化合物最最多的元素 |
| B | L层s电子数比p电子数少l |
| C | 地壳中含量最高的元素 |
| D | 第三周期中可以作为半导体材料的元素 |
| E | 第四周期中最外层只有一个电子且内层完全排满电子的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | HF、HCl、HBr、HI的沸点依次升高 | B. | HF、HCl、HBr、HI还原性依次增强 | ||
| C. | HF、HCl、HBr、HI稳定性依次增强 | D. | HF、HCl、HBr、HI酸性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水玻璃中加入稀盐酸:Na2SiO3+2H+=H2SiO3↓+2Na+ | |
| B. | 铝与稀硝酸反应:2Al+6H+═2Al3++3H2↑ | |
| C. | 氯化铝溶液和过量氨水反应:Al3++3NH3•H2O═3NH4++Al (OH)3↓ | |
| D. | 向硅酸钠溶液中通入过量二氧化碳:SiO32-+CO2+H2O═H2SiO3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中四原子共直线,是非极性分子 | |
| B. | N≡C键的键长大于C≡C键的键长 | |
| C. | 分子中含有2个σ键和4个π键 | |
| D. | 氰气不和氢氧化钠溶液发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从溴水中提取单质溴时,不能用无水乙醇代替CCl4 | |
| B. | 可用新制的Cu(OH)2悬浊液检验牙膏中存在的甘油 | |
| C. | 用纸层析法分离Cu2+和Fe3+,滤纸上端呈棕黄色,说明Fe3+在固定相中分配的更多 | |
| D. | 纸层析实验中,不能将滤纸上的试样点浸入展开剂中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加冰醋酸 | B. | 加CH3COONa | C. | 加水 | D. | 加NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| J | ||||
| R |
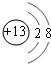 ;元素T基态原子的价电子排布式为3s23p5.
;元素T基态原子的价电子排布式为3s23p5.| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入H2的物质的量 | 加入甲的物质的量 |
| y | 甲的物质的量 | 平衡常数K | 甲的转化率 | 生成物总物质的量 |
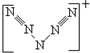 ,其中可能含有4个σ键,4个π键,4对孤电子对.
,其中可能含有4个σ键,4个π键,4对孤电子对.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com