
����Ŀ��Ԫ�����ڱ���ѧϰ��ѧ����Ҫ���ߡ��±�Ϊ8��Ԫ�������ڱ��е�λ�á�

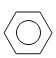
��1����ͼ��ʾ��ģ�ͱ�ʾ�ķ����У�����A��D�γɵ���________��

д��c���ӵĿռ乹��Ϊ_________��d���ӵĽṹ��ʽ _________��
��2������a����ϩ���������������⣺
�����a�����е�һ����ԭ�ӱ���ȡ����õ�����������ͬһƽ�� ��ԭ�������_______����
��a��ʹ���ˮ��Һ��ɫ���÷�Ӧ���������������_______����������
��a�����������ӳɷ�Ӧ�����ɷ���e��e�ڷ�����ɺͽṹ�����Ƶ��л�����һ���ࣨ�ֳơ�ͬϵ��������Ǿ�����ͨʽCnH2n+2����n��______ʱ�������л��↑ʼ����ͬ���칹�壬д�������������е�ͬ���칹��ṹ��ʽ_______________________��
��3��Na��R�ĵ���������ȼ�ղ���ĵ���ʽΪ___________��Na��F������ȼ�յIJ�����______����д��ѧʽ��
��4������Ԫ�ص�����������ˮ�����У�������ǿ����______����д��ѧʽ������Q�ĵ��ʷ�Ӧ�����ӷ���ʽ��_________________________��
���𰸡� ![]() ��������
��������  7 1��2һ�������� 4
7 1��2һ�������� 4 ![]() ��C(CH3)3
��C(CH3)3 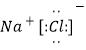
![]()
![]()
![]()
������������Ԫ���������ڱ��е�λ�ÿ�֪AΪHԪ�أ�DΪCԪ�أ�FΪOԪ�أ�GΪMgԪ�أ�QΪAlԪ�أ�MΪSԪ�أ�RΪClԪ�أ�NΪKԪ�أ�
(1)��ϩ�ĽṹΪƽ���ͷ��ӣ�����Ϊ�������壻����Ϊ�����Σ���Ϊƽ���ͷ��ӣ�����a��c��d����̼��������Ԫ���γɣ�b��N��H����Ԫ���γɣ�
c���ӵĿռ乹��Ϊ�������壻���Ľṹ��ʽΪ![]() ��
��
(2)�ټ�������������ṹ�������3��ԭ�ӹ��棬��ϩ��ƽ���ͽṹ�������6��ԭ�ӹ��棬����a�����е�һ����ԭ�ӱ���ȡ����õ������ʱ�ϩ����ͬһƽ���ԭ�������7����
����ϩ����ˮ�����ӳɷ�Ӧ����1��2-�������飻
�۸��������м��顢���顢����û��ͬ���칹�壬�Ӷ��鿪ʼ����ͬ���칹�壬����n=4�������ͬ���칹���У�CH3CH2CH2CH3��(CH3)2CHCH3��
(3)Na��Cl2��ȼ������NaCl���Ȼ���Ϊ���ӻ��������ʽΪ��![]() ��Na��O2��ȼ������Na2O2��
��Na��O2��ȼ������Na2O2��
(4)��������ǿ��Ԫ��Ϊ�������ڢ�A��Ԫ��K����Ӧ����������ˮ����KOH�ļ�����ǿ����Al��Ӧ�����ӷ���ʽΪ2Al+2OH-+2H2O=2AlO-2+3H2����


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ�и�����Ũ�ȹ�ϵ����ȷ���� �� ��
A. pH=2��HA��Һ��pH=12��MOH��Һ����Ȼ�ϣ�c(H+) + c(M+) == c(OH-) + c(A-)
B. 1 L 0.1 mol��L��1 (NH4)2Fe(SO4)2����Һ�У�c(SO![]() )��c(NH
)��c(NH![]() )��c(Fe 2+)��c(H��)��c(OH��)
)��c(Fe 2+)��c(H��)��c(OH��)
C. 0.1 mol��L��1 NaHCO3��Һ�У�c(H��)��c(H2CO3)��c(CO![]() )��c(OH��)
)��c(OH��)
D. 0.1mol��L-1��NaHA��Һ����pH=4��c(HA-)��c(H+)��c(H2A)��c(A2-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ϸ������Ͻ�ʯī����
A. ���Ӿ��� B. ԭ�Ӿ��� C. �������� D. ����;���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʵ���ҽ�����������ʱ��Ҫ�õ��������ǣ� ��
A.������
B.��Һ©��
C.����©��
D.�¶ȼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����120��ʱ��ij���������O2��һ�ܱ���������ȫ��Ӧ����֪��Ӧǰ���ѹǿû�б仯����û���������ǣ� ��
A. CH4��C2H4 B. C2H2��C2H4
C. C2H4��C2H6 D. C3H4��C3H6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Cu��Zn�����Ͷ��ϡHNO3�У���ַ�Ӧ��п��ʣ�࣬��Ӧ�����Һ�п϶������ڵ��� ��Cu ��Cu��NO3��2��HNO3��Zn��NO3��2�� ��
A.�ٺ͢�
B.�ں͢�
C.�ٺ͢�
D.�ں͢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���п���˵��2HI��g��![]() H2��g��+I2��g���Ѵﵽƽ��״̬���ǣ� ��
H2��g��+I2��g���Ѵﵽƽ��״̬���ǣ� ��
��1����λʱ��������n mol H2��ͬʱ����n mol HI
��2��һ��H��H�����ѵ�ͬʱ������H��I������
��3��c(HI)= c(I2)
��4����Ӧ���ʦ�(H2)=��(I2)=0.5��(HI)
��5��c(H2)��c(I2)��c(HI)=2��1��1
��6���¶Ⱥ����һ��ʱ��ijһ������Ũ�Ȳ��ٱ仯
��7���¶Ⱥ����һ��ʱ��������ѹǿ���ٱ仯
��8������һ������������ƽ����Է����������ٱ仯
��9���¶Ⱥ����һ��ʱ������������ɫ���ٷ����仯
��10���¶Ⱥ�ѹǿһ��ʱ�����������ܶȲ��ٷ����仯
A. ��1����2����5����9����10�� B. ��2����6����9�� C. ��6����7����10�� D. ȫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ճ�������,���н������ķ��������е���( )
A. Ϊ�ӿ�Ư����Ư������,ʹ��ʱ�ɵμӼ��δ��� B. Ϊ��ֹ���ʸ���,�ɽ����ʲ�Ʒ����������ͭ��Һ��
C. Ϊ��ǿ����ȱ����ƶѪЧ��,���ڿڷ���������Ƭʱͬ��ά����![]() D. Ϊʹˮ������,����ˮ�����ڷ�����������Һ?���ݹ��Ĺ�����
D. Ϊʹˮ������,����ˮ�����ڷ�����������Һ?���ݹ��Ĺ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ����ԼΪ22.4 L����
A. ��״����1molCO2B. 28gN2
C. ��״����1 mol H2OD. 1molH2
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com