
| A. | 糖类、油脂和蛋白质都可以用来酿酒 | |
| B. | 工业酒精不能用来勾兑饮用酒水 | |
| C. | 葡萄糖转化为酒精的过程中放出热量 | |
| D. | 米酒储存不当容易变质发酸,原因是乙醇被氧化成乙酸 |
分析 A.油脂和蛋白质不能得到乙醇;
B.工业酒精含有毒的甲醇;
C.葡萄糖转化为酒精,为分解反应;
D.米酒储存不当容易变质发酸,-OH转化为-COOH.
解答 解:A.油脂和蛋白质不能得到乙醇,糖类可用来酿酒,故A错误;
B.工业酒精含有毒的甲醇,不能用来勾兑饮用酒水,故B正确;
C.葡萄糖转化为酒精,为分解反应,生成物的能量低,则该过程中放出热量,故C正确;
D.米酒储存不当容易变质发酸,-OH转化为-COOH,则乙醇被氧化成乙酸,故D正确;
故选A.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意有机反应及化学与生活的联系,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
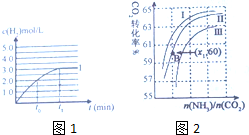 氨气是一种重要的化工产品,在生产和科研中应用广泛,氨气是工业合成氨的原料之一,工业上制取氨气有下列两种途径:
氨气是一种重要的化工产品,在生产和科研中应用广泛,氨气是工业合成氨的原料之一,工业上制取氨气有下列两种途径:| 弱电解质 | 化学式 | 电离常数(K) |
| 氨水 | NH3•H2O | 1.79×10-5 |
| 碳酸 | H2CO3 | K1=4.30×10-7 |
| K2=5.61×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原剂 | B. | 氧化剂 | ||
| C. | 既是氧化剂又是还原剂 | D. | 既不是氧化剂又不是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 的烃X,根据分析,下列说法中不正确的是( )
的烃X,根据分析,下列说法中不正确的是( )| A. | X的分子式为C5H4 | |
| B. | 分子中氢原子的化学环境有2种 | |
| C. | 1 mol X在一定条件下可与2 mol氢气发生反应 | |
| D. | X不能使高锰酸钾酸性溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨是重要的化工原料,用途广泛.
氨是重要的化工原料,用途广泛.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从海水中提取溴的过程涉及氧化还原反应 | |
| B. | 海水含镁元素,将金属钠放入海水中可以制取金属镁 | |
| C. | 利用潮汐能发电是将化学能转化为电能 | |
| D. | 海底多金属结核矿是锰、硼、钛等的主要来源 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正反应速率等于逆反应速率 | B. | 反应不再进行,反应速率降为零 | ||
| C. | 反应体系中混合物的组成保持不变 | D. | 反应物和生成物浓度不再发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com