
| A. | 20倍 | B. | 100倍 | C. | 200倍 | D. | 500倍 |
分析 两溶液的pH相同,则氢离子浓度相同,设氢离子浓度为n,一元强酸的物质的量为n,弱酸的物质的量为:$\frac{n}{0.5%}$=200n,然后结合中和反应实质计算出消耗X、Y溶液体积关系,据此进行解答.
解答 解:溶液体积和pH都相同的一元强酸X与一元弱酸溶液Y,两溶液的pH相同,则氢离子浓度相同,设氢离子浓度为n,一元强酸的物质的量为n,该一元弱酸的物质的量为:$\frac{n}{0.5%}$=200n,
设NaOH溶液浓度为c,则X消耗氢氧化钠溶液的体积为:$\frac{n}{c}$,Y消耗氢氧化钠溶液体积为:$\frac{200n}{c}$,
所需Y溶液的体积是X溶液的倍数为:$\frac{\frac{200n}{c}}{\frac{n}{c}}$=200,
故选C.
点评 本题考查了弱电解质的电离平衡,题目难度不大,正确判断两溶液的浓度关系为解答关键,注意掌握弱电解质的电离平衡及其影响,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 操作 | |
| A | 观察钠与水反应的现象 | 用镊子从煤油中取出金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中 |
| B | 检验NaHCO3与Na2CO3溶液 | 用小试管分别取少量溶液,然后滴加澄清石灰水 |
| C | 证明Na2O2与CO2是放热反应 | Na2O2用棉花包裹,放入充满CO2的集气瓶中,棉花燃烧说明是放热反应 |
| D | 检验Na2CO3与K2CO3溶液 | 用稀硫酸清洗过的铂丝分别蘸取溶液,在酒精灯外焰上灼烧,透过蓝色钴玻璃观察火焰的颜色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:8 | B. | 2:5 | C. | 5:2 | D. | 5:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a=b | B. | a=10-4b | C. | a=104b | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 80% | B. | 85% | C. | 90% | D. | 95% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol CH3CH2CH2CH3分子储存的能量大于1 mol (CH3)2CHCH3分子 | |
| B. | 1 mol CH3CH2CH2CH3分子储存的能量小于1 mol (CH3)2CHCH3分子 | |
| C. | (CH3)2CHCH3转化为CH3CH2CH2CH3的过程是一个放热过程 | |
| D. | 断开1 mol物质中化学键吸收的能量CH3CH2CH2CH3大于(CH3)2CHCH3 |
查看答案和解析>>
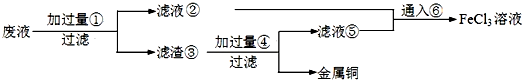
科目:高中化学 来源: 题型:推断题
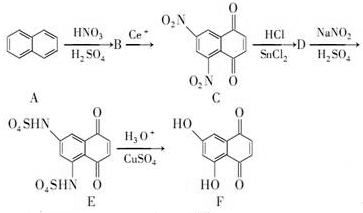
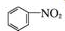 +SnCl2$\stackrel{HCl}{→}$
+SnCl2$\stackrel{HCl}{→}$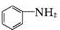 +SnCl4
+SnCl4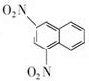 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com