
0.02 mol KMnO4固体加热一段时间后,收集到a mol甲气体,在反应后的残留固体中加入足量的浓盐酸,继续加热,又收集到b mol乙气体,设此时Mn元素全部以Mn2+存在于溶液中,则下列说法正确的是 ( )
A.甲、乙均为无色无味的气体
B.a的最大值为0.02
C.b的最小值为0.01
D.a+b的 最小值为0.04
最小值为0.04
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:
对于短周期元素,下列说法正确的是( )
A、若两元素原子序数相差8,则周期数一定相差1
B、两种简单离子不可能相差3个电子层
C、同族的两元素之间不可能形成化合物
D、最外层电子数相同的元素一定位于同一族
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸钾(K2FeO4)具有很强的氧化性,是一种新型的高效水处理剂。
(1)高铁酸钾具有强氧化性的原因是 。
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为 ,___ _____。
(3)制备K2FeO4可以采用干式氧化法或湿式氧化法。
① 干式氧化的初始反应是2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中每生成2 mol Na2FeO4时转移电子 mol。
② 湿式氧化法的流程如下图:
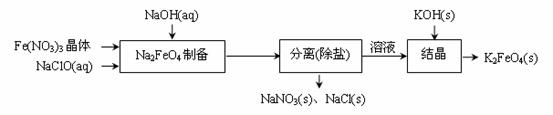
上述流程中制备Na2FeO4的化学方程式是 。
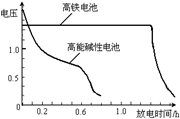
(4)高铁电池是正在研制中的可充电电池,右图为该电池和常用的高能
碱性电池的放电曲线,由此可得出的高铁电池的优点有 、
。
(5)探究高铁酸钾的某种性质。
【实验1】将适量K2FeO4固体分别溶解于pH 为 4.74、7.00、11.50 的水溶液中,配得FeO42-浓度为 1.0 mmol·L-1(1 mmol·L—1 =10—3 mol·L—1)的试样,静置,考察不同初始 pH 的水溶液对K2FeO4某种性质的影响,结果见图1(注:800 min后,三种溶液中高铁酸钾的浓度不再改变)。
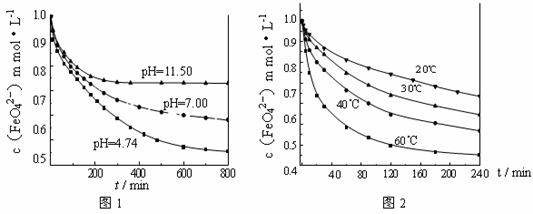
【实验2】将适量 K2FeO4 溶解于pH=4.74 的水溶液中,配制成FeO42-浓度为
1.0 mmol·L-1 的试样,将试样分别置于 20℃、30℃、40℃和60℃的恒温水浴中,考察不同温度对K2FeO4某种性质的影响,结果见图2。则
①实验1的目的是 ;
②实验2可得出的结论是 ;
③高铁酸钾在水中的反应为4 FeO42—+10 H2O 4 Fe(OH)3 +8OH—+3 O2↑。 由图1可知,800 min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,主要原因是
4 Fe(OH)3 +8OH—+3 O2↑。 由图1可知,800 min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,主要原因是
。
查看答案和解析>>
科目:高中化学 来源: 题型:
目前,新能源不断被应用到现代的汽车中,高铁电池技术就是科研机构着力研究的一个方向。
(1)高铁酸钾锌电池(碱性介质)是一种典型的高铁电池,则该种电池负极材料是________。
(2)工业上常采用NaClO氧化法生产高铁酸钾(K2FeO4),K2FeO4在碱性环境中稳定,在中性和酸性条件下不稳定。反应原理为
Ⅰ.在碱性条件下,利用NaClO氧化Fe(NO3)3制得Na2FeO4
3NaClO+2Fe(NO3)3+10NaOH===2Na2FeO4↓+3NaCl+6NaNO3+5H2O
Ⅱ.Na2FeO4与KOH反应生成K2FeO4
Na2FeO4+2KOH===K2FeO4↓+2NaOH
主要的生产流程如下:

①写出反应①的离子方程式________________________________________________。
②流程图中“转化”(反应③)是在某低温下进行的,且此温度无NaOH析出,说明此温度下Ksp(K2FeO4)____Ksp(Na2FeO4)(填“>”、“<”或“=”)。
(3)已知K2FeO4在水溶液中可以发生:__FeO +__H2O__Fe(OH)3↓+__OH-+__O2↑,配平上述方程式K2FeO4在水处理中的作用是__________________。
+__H2O__Fe(OH)3↓+__OH-+__O2↑,配平上述方程式K2FeO4在水处理中的作用是__________________。
(4)FeO 在水溶液中的存在形态如图所示:
在水溶液中的存在形态如图所示:

①若向pH=10的这种溶液中加硫酸至pH=2,HFeO 的分布分数的变化情况是________。
的分布分数的变化情况是________。
②若向pH=6的这种溶液中滴加KOH溶液,则溶液中含铁元素的微粒中,________转化为____________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关反应SiO2+3C SiC+2CO↑的叙述中,正确的是 ( )
SiC+2CO↑的叙述中,正确的是 ( )
A.氧化剂是SiO2
B.氧化剂与还原剂的物质的量之比为1∶2
C.碳在反应中只作还原剂
D.若生成1 mol SiC,则转移电子2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
小明为验证NO2的氧化性和NO的还原性,设计了如下装置制取NO2和NO,并验证其性质,装置图如下:
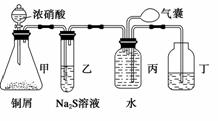
(1)写出甲中反应的离子方程式:______________________________________________
________________,乙中的现象是__________________________________________,
可证明NO2的氧化性;在丙中鼓入空气后现象是_______________________________
________________________________________________________________________,可证明NO的还原性。
(2)实验前丙中充满水的作用是_______________________________________________
________________________________________________________________________
(用反应方程式和简要文字回答)。
(3)小华对小明的实验设计提出了质疑,他认为乙中的现象不足以证明NO2的氧化性,他的理由是_________________________________________________________________
________________________________________________________________________。
你认为怎样才能准确证明NO2的氧化性?(简要回答出原理和现象即可)____________
____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
为了测定中和反应的反应热,计算时至少需要的数据是
①酸的浓度和体积 ②碱的浓度和体积 ③比热容 ④反应后溶液的质量 ⑤生成水的物质的量 ⑥反应前后溶液温度变化 ⑦操作所需的时间
A.①②③⑥ B.①③④⑥
C.③④⑤⑥ D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
化学是一门实用性强的自然科学,在社会、生产、生活中起着重要的作用,下列说法正确的是
A.金属钠具有强还原性,可用与TiCl4溶液反应制取金属Ti
B. 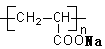 表示一种吸水性高分子树脂
表示一种吸水性高分子树脂
C.用于现代建筑的钢筋混凝土不属于复合材料
D.山东东营广饶县一男子收到网购物品后,因吸入氟乙酸甲酯中毒身亡,氟乙酸甲酯的结构
简式为FCH2COOCH3,能与H2发生加成反应,也能被LiAlH4还原
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于可逆反应的叙述正确的是:
A.可逆反应是指既能向正反应方向进行,同时又能向逆反应方向进行的反应
B.2H2O 2H2+O2与2H2+O2
2H2+O2与2H2+O2 2H2O互为可逆反应
2H2O互为可逆反应
C.对于可逆反应,当正反应速率增大时,逆反应速率就会减小
D.外界条件对可逆反应的正、逆反应速率影响的程度不一定相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com