
分析 羧酸的官能团为羧基;乙酸酸性比碳酸强,乙酸与碳酸钙反应生成乙酸钙与二氧化碳、水.蔗糖为二糖,水解生成葡萄糖和果糖,以此解答.
解答 解:羧酸的官能团为羧基,乙酸中含有羧基;乙酸具有酸的通性,且酸性比碳酸强,能与碳酸盐反应:2CH3COOH+CaCO3=(CH3COO)2Ca+H2O+CO2↑,蔗糖为二糖,水解生成葡萄糖和果糖,方程式为C12H22O11+H2O$\stackrel{催化剂}{→}$C6H12O6(葡萄糖)+C6H12O6(果糖).
故答案为:羧基; 2CH3COOH+CaCO3=(CH3COO)2Ca+H2O+CO2↑;C12H22O11+H2O$\stackrel{催化剂}{→}$C6H12O6(葡萄糖)+C6H12O6(果糖).
点评 本题考查乙酸、蔗糖的性质,为高频考点,侧重于双基的考查,有利于培养学生良好的科学素养,提高学习的积极性,难度不大,注意相关基础知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | 16g 甲烷中含有的原子数为NA | |
| B. | 标准状况下,2.24 LCCl4含有的共价键数为0.4NA | |
| C. | 4.6 g乙醇中含有的C-H键的个数为0.6NA | |
| D. | 14 g乙烯和丙烯(它是乙烯的同系物,相对分子质量相差14)混合气体中的氢原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3═2Na++CO32- | B. | AlCl3═Al3++3Cl- | ||
| C. | Mg(NO3)2═Mg+2+2NO3- | D. | KMnO4═K++Mn7++4O2- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 有机高分子化合物被称为聚合物或高聚物,是因为它们大部分是由小分子通过聚合反应而得到的 | |
| B. | 有机高分子化合物的相对分子质量很大,因而其结构很复杂 | |
| C. | 对于一块高分子材料来说,n是一个整数值,因而它的相对分子质量是确定的. | |
| D. | 材料可分为天然高分子材料和合成高分子材料两大类 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
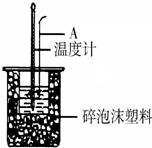 利用如图装置测定中和热的实验步骤如下
利用如图装置测定中和热的实验步骤如下查看答案和解析>>
科目:高中化学 来源: 题型:解答题
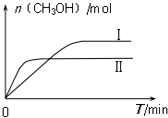 研究CO、CO2的应用具有重要的意义.
研究CO、CO2的应用具有重要的意义.| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 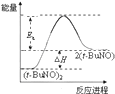 | B. | 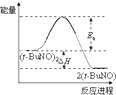 | C. | 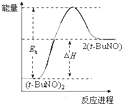 | D. | 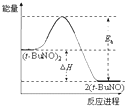 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | OCS中含有1个σ键和1个π键 | |
| B. | OCS高温分解时,碳元素化合价升高 | |
| C. | OCS、CO2、CO、S晶体类型相同 | |
| D. | 22.4 L OCS中约含有3×6.02×1023个原子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com