
【题目】元素周期表中第116号元素已由俄罗斯科学家找到.假设第116号元素的元素符号为R,则下列有关叙述中不正确的是( ) ①R的非金属性比S强
②R元素原子的内层电子共有110个
③R是过渡金属元素
④R元素原子的最高价氧化物对应的水化物为强酸
⑤R元素的最高价氧化物的化学式为RO3 .
A.①③④
B.①②④
C.③④
D.②⑤
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式不正确的是()
A. 铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑
B. 氢氧化钠溶液与盐酸反应:OH-+H+=H2O
C. 锌与硫酸铜溶液反应:Zn+Cu2+=Zn2++Cu
D. 氯化钡溶液与稀硫酸反应:SO42-+Ba2+= BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应在生产生活中有着重要的应用。请按要求写出相应的方程式。
(1)二氧化硫是一种污染性气体,工业上常利用Fe2+的催化作用,常温下使SO2转化为SO42-,其总反应为2SO2+O2+2H2O=2H2SO4。上述总反应分两步进行,第一步反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,写出第二步反应的离子方程式: _____________________________。
(2)ClO2是一种高效的杀菌消毒剂。氯化钠电解法生产ClO2工艺原理示意图如下:

①氯化钠电解槽内的阳极产物为:__________。
②二氧化氯发生器所产生的气体中二氧化氯的体积分数为:__________。
③ClO2能将电镀废水中的CN-离子氧化成两种无毒气体,自身被还原成Cl-。写出该反应的离子方程式_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W各代表一种物质,若X+Y=Z+W,则X和Y之间不可能是( )
A. 盐和盐的反应 B. 碱性氧化物和水的反应
C. 酸与碱的反应 D. 酸性氧化物和碱的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭、导弹的工作电源。该电池以Ca为负极,熔融无水LiClKCl混合物作电解质,结构如图所示。正极反应式为PbSO4+2Li++2e-===Li2SO4+Pb。下列说法不正确的是( )
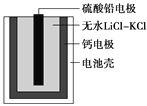
A. 放电过程中,Li+向正极移动
B. 常温下电解质是不导电的固体,电池不工作
C. 每转移0.1 mol电子,理论上生成20.7 g Pb
D. 该电池总反应为PbSO4+2LiCl+Ca===CaCl2+Li2SO4+Pb
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠是重要的防腐剂.某化学兴趣小组以碳和浓硝酸为起始原料,设计如下装置利用一氧化氮与过氧化钠反应制备亚硝酸钠.(夹持装置和A中加热装置已略,气密性已检验) 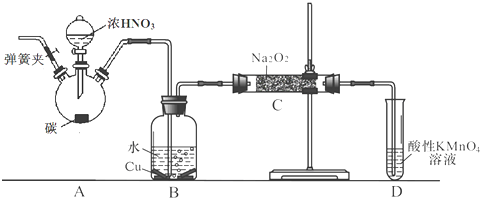
查阅资料:①HNO2为弱酸,室温下存在反应3HNO2=HNO3+2NO↑+H2O;
②在酸性溶液中,NO2﹣可将MnO4﹣还原为Mn2+且无气体生成.
③NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸
实验操作:
①关闭弹簧夹,打开A中分液漏斗活塞,滴加一定量浓硝酸,加热;
②一段时间后停止加热;
③从C中取少量固体,检验是否是亚硝酸钠.
(1)A中反应的化学方程式是 .
(2)B中观察的主要现象是 , D装置的作用是 .
(3)经检验C产物中亚硝酸钠含量较少. a.甲同学认为C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠.
生成碳酸钠的化学方程式是 . 为排除干扰,甲在B、C装置间增加装置E,E中盛放的试剂应是(写名称).
b.乙同学认为除上述干扰因素外,还会有空气参与反应导致产品不纯,所以在实验操作①前应增加一步操作,该操作是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛(HCHO)与葡萄糖相似具有还原性。为探究过量甲醛和新制Cu(OH)2反应的产物,进行如下研究。
(1)在右图装置中进行实验,向a中加入0.5 mol/LCuSO4溶液50mL和5mol/LNaOH溶液100mL,振荡,再加入40%的甲醛溶液50mL,缓慢加热a20分钟后冷却至室温。

①盛装甲醛溶液的仪器名称是______________;
②能说明甲醛具有还原性的实验现象是______________。
(2)上述实验有副反应发生,产生的气体为CO、H2中的一种或两种。为确认气体成分, 将装置A和下图中部分装置连接后进行实验。

依次连接的合理顺序为A→B→____→____→____→____→G。
装置B的作用是____________。
证明有H2的实验现象是____________。
(3)反应后a中有红色固体产生,为研究其组成,进行如下实验(每步均充分反应):

已知:Cu2O![]() [Cu(NH3)4]+(无色)
[Cu(NH3)4]+(无色)![]() [Cu(NH3)4]2+(蓝色)
[Cu(NH3)4]2+(蓝色)
① 锥形瓶ii中固体完全溶解得深蓝色溶液的离子方程式为__________;
②将容量瓶ii中的溶液稀释100倍后,溶液的颜色与容置瓶i相近。由此可知固体产物的组成及物质的量之比约为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A. 图①可表示将SO2气体通入溴水时pH的变化
B. 图②表示KNO3的溶解度曲线,a点是80 ’C的KNO3的不饱和溶液
C. 图③表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
D. 图④表示室温下,0.100 mol/L NaOH溶液分別滴定0.100mol/L的盐酸和醋酸的滴定曲线,由图知I为盐酸的滴定曲线。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com