
科目:高中化学 来源: 题型:选择题
| A. | 醋酸与水能以任意比互溶 | B. | 醋酸溶液能导电 | ||
| C. | 醋酸溶液中存在醋酸分子 | D. | 醋酸能和碳酸钙反应放出CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质燃烧都是吸热反应 | B. | 化学反应总是伴随着能量的变化 | ||
| C. | 需要加热的反应一定是吸热反应 | D. | 化学反应中放出的热量就是反应热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④① | B. | ④①②③ | C. | ①④②③ | D. | ③②①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
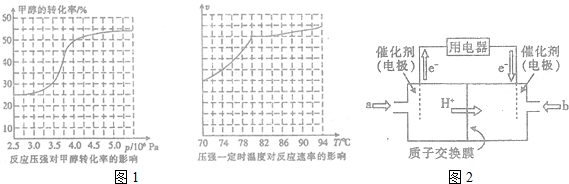
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
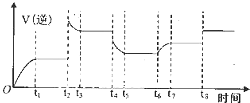 合成氨工业上常用下列方法制备H2:
合成氨工业上常用下列方法制备H2:| 容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| C(s) | H2O(g) | H2(g) | ||||
| 甲 | 2 | T1 | 2 | 4 | 3.2 | 2.5 |
| 乙 | 1 | T2 | 1 | 2 | 1.2 | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.
掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com