
分析 (1)由题意可知,当5L×0.2=1L的Cl2和5L×(1-0.2)=4L的NO2反应或5L×0.6=3LCl2和5L-3L=2L的NO2反应,最后均得4L气体,可推出1LCl2与2LNO2正好反应生成2L气态新物质.由阿伏加德罗定律,可知反应Cl2、NO2、新物质的物质的量比例为1:2:2,利用质量守恒定律,该反应为:Cl2+2NO2=2NClO2;
(2)由写出的方程式进行讨论型过量计算,当V(Cl2):V(NO2)=1:2时,即x=$\frac{1}{3}$时,二者正好反应,当x>$\frac{1}{3}$时,Cl2过量,同理得到当x<$\frac{1}{3}$时,得V=5(1-x)L,结合方程式计算解答.
解答 解:(1)由题意可知,5L×0.2=1L的Cl2和5L×(1-0.2)=4L的NO2反应或5L×0.6=3LCl2和5L-3L=2L的NO2反应,最后均得4L气体,可推出1LCl2与2LNO2正好反应生成2L气态新物质,由阿伏加德罗定律,可知反应Cl2、NO2、新物质的物质的量比例为1:2:2,利用质量守恒定律可得反应方程式:Cl2+2NO2=2NClO2,
答:反应的化学方程式为Cl2+2NO2=2NClO2;
(2)当V(Cl2):V(NO2)=1:2=时,即x=$\frac{1}{3}$时,二者正好反应,生成NClO2气体V=5L×$\frac{1}{3}$×2=$\frac{10}{3}$L;
当x>$\frac{1}{3}$时,Cl2过量,则:
Cl2+2 NO2=2NClO2 △V
1 2 2 1
(5-5x)L 0.5(5-5x)L
V=5L-0.5(5-5x)L=2.5(x+1)L,
同理得到当x<$\frac{1}{3}$时,NO2过量,则:
Cl2+2NO2=2NClO2 △V
1 2 2 1
5xL 5xL
V=5L-5x L=5(1-x)L,
即:0<x≤$\frac{1}{3}$,V=5(1-x)L;$\frac{1}{3}$≤x<1,V=2.5(1+x)L,
答:反应后总体积V随x变化的函数关系为0<x≤$\frac{1}{3}$,V=5(1-x)L;$\frac{1}{3}$≤x<1,V=2.5(1+x)L.
点评 本题考查混合物反应的计算、化学方程式有关计算,题目难度中等,确定发生的反应是解题关键,注意掌握讨论法在化学计算中的应用,试题培养了学生的分析、理解能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 原子数 | B. | 分子数 | C. | 质量 | D. | 密度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Fe+3Cl2 $\frac{\underline{\;点燃\;}}{\;}$2FeCl3 | B. | NH4Cl $\frac{\underline{\;\;△\;\;}}{\;}$ NH3↑+HCl↑ | ||
| C. | 2Na+2H2O═2NaOH+H2↑ | D. | Cl2+2KI═2KCl+I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 mL | B. | 90 mL | C. | 100 mL | D. | 450 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
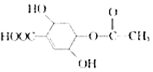 的叙述中不正确的是( )
的叙述中不正确的是( )| A. | 该物质能发生水解反应,1 mol该有机物能与2mo1的NaOH反应 | |
| B. | 该物质可使溴水褪色 | |
| C. | 该物质与Na2CO3溶液反应放出CO2 | |
| D. | 该物质遇FeCl3溶液显色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某溶液中加入稀盐酸,产生无色气体,证明该溶液中一定有CO32- | |
| B. | 某溶液中先加少量氯化钡溶液,再加足量稀盐酸生成白色沉淀,证明该溶液中一定含有SO42- | |
| C. | 验证烧碱溶液中是否有Cl-,先加稀硝酸除去OH-,再加AgNO3溶液,有白色沉淀产生,证明有Cl- | |
| D. | 某无色溶液滴入紫色石蕊试液显红色,该溶液一定显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
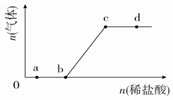 向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.则下列离子组在对应的溶液中,一定能大量共存的是( )
向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.则下列离子组在对应的溶液中,一定能大量共存的是( )| A. | b点对应的溶液中:Al3+、Fe3+、MnO4-、Cl- | |
| B. | a点对应的溶液中:Na+、OH-、SO42-、NO3- | |
| C. | d点对应的溶液中:F-、NO3-、Fe2+、Na+ | |
| D. | c点对应的溶液中:Na+、Ca2+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯能使酸性KMnO4溶液褪色 | |
| B. | 甲苯能与浓硝酸浓硫酸反应生成三硝基甲苯 | |
| C. | 甲苯能与H2发生加成反应 | |
| D. | 甲苯能萃取溴水中的溴 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com