
| A. | 常温下,7.8g固体Na2O2中,含有的阴阳离子总数为0.4NA | |
| B. | 4℃时,18g2H216O中含有共用电子对数为2NA | |
| C. | 用金属铁、Cu片、稀硫酸组成原电池,当金属铁质量减轻5.6g时,流过外电路的电子为0.3NA | |
| D. | 1mol N5+含有的电子数为34NA |
分析 A、1mol过氧化钠中含有2mol钠离子、1mol过氧根离子,总计3mol阴阳离子;
B、1mol2H216O含有2mol共用电子对,根据n=$\frac{m}{M}$计算2H216O的物质的量,再根据N=nNA计算共用电子对数目;
C、铁在反应表现+2价,根据n=$\frac{m}{M}$计算铁物质的量,再根据N=nNA计算电子数目;
D、1molN5+含34mol电子.
解答 解:A、由于1mol过氧化钠中含有2mol钠离子、1mol过氧根离子,总计3mol阴阳离子,7.8g过氧化钠的物质的量是0.1mol,总计含有0.3mol阴阳离子,含有阴阳离子总数为0.3NA,故A错误;
B、18g2H216O中含有共用电子对数为$\frac{18g}{20g/mol}$×2×NAmol-1=1.8NA,故B错误;
C、铁在反应表现+2价,当金属铁质量减轻5.6g时,流过外电路的电子数为$\frac{5.6g}{56g/mol}$×2×NAmol-1=0.2NA,故C错误;
D、1molN5+含34mol电子,即34NA,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
 和化学式中M分别代表阳离子,图中
和化学式中M分别代表阳离子,图中 和化学式中N分别代表阴离子,则化学式为MN的晶体结构为( )
和化学式中N分别代表阴离子,则化学式为MN的晶体结构为( )| A. | 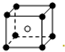 | B. | 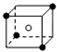 | C. | 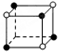 | D. | 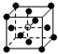 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | W | X | Y | Z |
| 性质或结构信息 | 单质制成的高压灯,发出的黄光透雾力强、射程远. | 工业上通过分离液态空气获得其单质.原子的最外层未达到稳定结构. | 单质常温常压下是气体,原子的M层差一个电子达稳定结构. | +2价阳离子的核外电子排布与氖原子相同. |
| A. | 上表中与W属于同一周期的元素是Z和Y | |
| B. | Z和Y形成的化合物属于离子化合物 | |
| C. | X的氢化物常温、常压下一定为液体 | |
| D. | Y单质为有色气体,具有强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3Br | B. | CH3CH2CH2CH2Br | C. | CH2BrCH2Br | D. | CH3CHBrCH2CH2Br |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
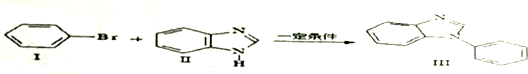
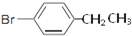 、
、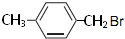 .
.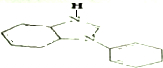 .
.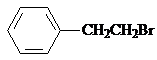 ,Ⅴ与氢氧化钠醇溶液加热条件下反应的方程式为:
,Ⅴ与氢氧化钠醇溶液加热条件下反应的方程式为: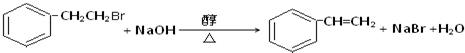 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 基态原子是处于最低能量状态的原子 | |
| B. | 基态C原子的电子排布式是1s22s12p3 | |
| C. | 焰色反应是金属原子的电子从基态跃迁到激发态时产生的光谱 | |
| D. | 同一原子处于激发态时的能量一定低于基态时的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 70 |
| (NH4)2SO4 | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
| FeSO4•7H2O | 40.0 | 48.0 | 60.0 | 73.3 | - | - |
| 摩尔盐 | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |
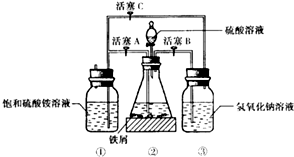
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com