
【题目】在25℃时,用蒸馏水稀释1mol/L的醋酸溶液至0.01mol/L,随溶液的稀释,下列各项中始终保持增大趋势的是( )
A.![]()
B.![]()
C.![]()
D.![]() 、
、
【答案】A
【解析】醋酸是弱电解质,在水溶液中存在电离平衡,加水稀释促进醋酸电离,所以溶液中c(CH3COOH)减小,但醋酸电离增大程度小于溶液体积增大程度,所以溶液中c(CH3COO﹣)、c(H+)都减小,温度不变水的离子积常数不变,所以c(OH﹣)增大,
A.加水稀释促进醋酸电离,所以溶液中c(CH3COOH)减小、c(H+)增大,因为溶液体积相同,所以 ![]() 增大,A符合题意;
增大,A符合题意;
B.加水稀释促进醋酸电离,所以溶液中c(CH3COOH)减小、c(H+)增大,溶液体积相等,所以 ![]() 减小,B不符合题意;
减小,B不符合题意;
C.加水稀释促进醋酸电离,所以溶液中c(CH3COOH)减小,c(CH3COO﹣)增大,溶液体积相等,所以 ![]() 减小,C不符合题意;
减小,C不符合题意;
D. ![]() =Ka,温度不变,电离平衡常数不变,所以
=Ka,温度不变,电离平衡常数不变,所以 ![]() 不变,D不符合题意;
不变,D不符合题意;
故答案为:A.
可利用Ka=![]() 由进行判断。A.B.根据越稀越电离c(CH3COOH)减小、c(H+)增大,所以
由进行判断。A.B.根据越稀越电离c(CH3COOH)减小、c(H+)增大,所以 ![]() 增大,
增大,![]() 减小,
减小, ![]() 减小,Ka不变。
减小,Ka不变。


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是(提示BaSO4(s)Ba2+(aq)+SO42﹣(aq)的平衡常数Ksp=[Ba2+][SO42﹣],称为溶度积常数)( ) 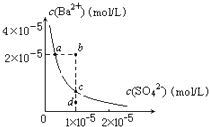
A.加入Na2SO4可使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp大于c点对应的Ksp
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各电离方程式中,书写正确的是( )
A.CH3COOH═H++CH3COO﹣
B.KHSO4K++H++SO42﹣
C.Al(OH)3Al3++3OH﹣
D.NaH2PO4Na++H2PO42﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g/L;W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是
A. 原子半径:W>Z>Y>X>M
B. 元素X与M形成的原子比为1:1的化合物只有一种
C. XZ2、X2M2、W2Z2均为直线型的共价化合物
D. 由X、Y、Z、M四种元素形成的化合物可能含有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纤维素、纤维素酶、DNA的基本组成单位分别是
A. 葡萄糖、氨基酸和脱氧核苷酸
B. 葡萄糖、葡萄糖和氨基酸
C. 氨基酸、氨基酸和脱氧核苷酸
D. 淀粉、蛋白质和脱氧核苷酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国许可使用的食盐抗结剂目前有:亚铁氰化钾、磷酸钙、二氧化硅和微晶纤维素。卫生部规定食盐中亚铁氰化[K4Fe(CN)6]的最大使用量为10mgkgˉ1.
(1)基态钾原子核外能量最高的电子所在能级的轨道数目为__________,K4Fe(CN)6中Fe2+的外围电子排布图为_________________。
(2)K4Fe(CN)6中存在_____________(填序号)。
A.离子键 B.非极性键 C.配位键 D.σ键 E.π键
(3)写出和CN-互为等电子体的离子的电子式为______________________
(4)磷酸钙中磷酸根的空间构型为______________,二氧化硅晶体中硅原子的杂化方式为_____
(5)亚铁氰化钾溶液与稀硫酸加热时发生非氧化还原反应,生成硫酸盐和一种与CN-是等电子体的气态化合物,反应化学方程式为_______________。
(6)FeO晶体的晶胞与NaCl的相似,NaCl的晶胞如图所示。由于晶体缺陷,某氧化亚铁晶体的实际组成为Fe0.9O,其中包含有Fe2+和Fe3+,晶胞边长为428pm,则该晶体的密度为____g/cm3 (列出计算式即可,用NA 表示阿伏伽德罗常数的值)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分短周期元素的性质或原子结构如表:
元素编号 | 元素性质或原子结构 |
A | 有3个电子层,K、M层电子数之和等于L层电子数 |
B | 短周期中金属性最强 |
C | 常温下单质为双原子分子,氢化物的水溶液呈碱性 |
D | 元素最高正价是+7价 |
用化学用语回答下列问题:
(1)A元素在周期表中的位置 __________________;
(2)C单质分子的结构式 ______________________;
(3)元素D与元素A相比,非金属性较强的是______(用元素符号表示),下列表述中能证明这一事实的是 ______(填选项序号)。
a.常温下D的单质和A的单质状态不同
b.D的氢化物比A的氢化物稳定
c.一定条件下D和A的单质都能与钠反应
d.A最高价含氧酸的酸性弱于D最高价含氧酸
e.D单质能与A的氢化物反应生成A单质
(4)X是由A、B、C、D四种元素中的某种元素组成的单质,能经图所示的过程转化为(其他条件略去)。![]()
①若Y是有刺激性气味的无色气体,把Y通入BaCl2溶液中,无现象,然后滴加适量H2O2溶液,有白色沉淀生成,则该白色沉淀为 _______________,试写出Y与H2O2溶液反应的化学方程式: __________________________________________;
②若Z是红棕色气体,则Z→W的反应中氧化剂与还原剂物质的量之比为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸铁锂动力电池(LiFePO4电池)是一种新型动力电池。电池的内部结构如图所示。中间是聚合物的隔膜,它把正极与负极隔开,Li+可以通过而e-不能通过。该电池的总反应式为:Li1-xFePO4+LixC6![]() C6 +LiFePO4 (注:LixC6是单质Li附在碳电极上的一种形式)。下列关于该电池的叙述错误的是
C6 +LiFePO4 (注:LixC6是单质Li附在碳电极上的一种形式)。下列关于该电池的叙述错误的是

A. 放电时, LixC6在负极上失电子发生氧化反应
B. 在充电时,正极中的Li+通过聚合物隔膜向负极迁移
C. 放电时,正极反应式为Li1-xFePO4+xLi+= LiFePO4-xe-
D. 若用该电池电解精炼铜,阴极质量增重19.2kg时,则电池中通过聚合物隔膜的Li+数目为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】充分燃烧2.8g某有机物A,生成8.8g CO2和3.6g H2O,这种有机物蒸气的相对密度是相同条件下N2的2倍.
(1)该有机物的分子式为 .
(2)该有机物链状同分异构体的结构简式为 .
(3)若在核磁共振氢谱中只有一个信号峰(即只有一种氢原子),则用键线式表示的结构简式为 . 该分子的所有碳原子能否在一个平面上(填“能”或“不能”) .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com