
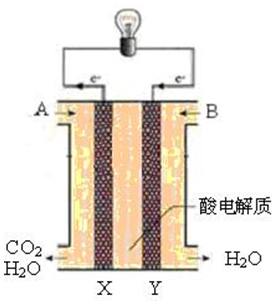
 氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关氢氧燃料电池的说法不正确的是( )
氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关氢氧燃料电池的说法不正确的是( )| A. | 该装置将化学能转化为电能 | |
| B. | 电极b附近的pH值增大 | |
| C. | 电子迁移方向:电极a→灯泡→电极b→电解质溶液→电极a | |
| D. | 该电池的总反应:2H2+O2═2H2O |
分析 氢氧燃料电池中,氢气易失电子发生氧化反应,所以通入氢气的电极是负极,氧气易得电子发生还原反应,所以通入氧气的电极是正极;氢氧燃料电池的产物是水,所以电池的总反应:2H2+O2═2H2O,据此分析解答.
解答 解:A.燃料电池中,将化学能转化为电能,故A正确;
B.燃料电池中,通入氧气的电极是正极,所以b电极是正极,b极氧气易得电子结合氢离子生成水,所以b附近的pH值增大,故B正确;
C.外电路中电子由负极到正极,所以由电极a通过导线流向电极b,但不能通过电解质溶液,故C错误;
D.氢氧燃料电池的正负极反应物分别为氢气和氧气,该电池的总反应:2H2+O2=2H2O,故D正确.
故选C.
点评 本题考查了燃料电池,侧重于原电池原理的考查,题目难度不大,注意氢氧燃料电池的反应产物为水,环保无污染.


科目:高中化学 来源: 题型:选择题
| A. | ②④⑥⑦ | B. | ②③⑥ | C. | ①②④⑦ | D. | ②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 农药波尔多液不能用铁制器皿盛放 | |
| B. | 维生素C能帮助人体将摄取的Fe3+还原为Fe2+,这说明维生素C有还原性 | |
| C. | 用硫酸可以洗去锅炉水垢 | |
| D. | 氮气常用作保护气,如填充灯泡、焊接保护等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤ | B. | ③⑤⑥ | C. | ②④⑥ | D. | ①②④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2被氧化 | |
| B. | NH3得到电子 | |
| C. | Cl2是氧化剂 | |
| D. | 反应每生成1molN2转移电子数约为8×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热条件下,20mL10mol/L浓硝酸与足量铜反应转移电子数为0.1NA | |
| B. | 78gNa2O2固体中含有的阴离子数目为2NA | |
| C. | 标准状况下,11.2 L由CH4和C2H4组成的混合气体中含有氢原子的数目为2 NA | |
| D. | 常温下,4gCH4中含有4NA个C-H共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com