
| A. | 只有①或② | B. | 只有②或④ | C. | 只有①或②或③ | D. | 上述物质均可 |
分析 根据铜的化学性质判断,如:铜不能与弱氧化性酸反应,但可以和强氧化性酸反应,能与具有氧化性的FeCl3溶液、酸性条件下的硝酸盐等反应.
解答 解:①铜能和氯化铁反应生成氯化亚铁和氯化铜,所以铜能在氯化铁溶液中溶解,故正确;
②因Fe2O3能与稀硫酸反应:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,Fe2(SO4)3能与铜粉反应:Fe2(SO4)3+Cu=2FeSO4+CuSO4,所以铜粉溶解,故正确;
③向稀硫酸反应加入硝酸铜后,溶液中含有氢离子和硝酸根离子,所以相当于溶液中含有硝酸,硝酸能和铜反应,3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,所以加入硝酸铜后能溶解铜,故正确;
④依据③的分析可知,加入硝酸钾,相当于加入硝酸根,也与硫酸中的氢离子构成硝酸致使铜溶解,故正确;
故选D.
点评 本题主要考查了金属铜的化学性质,对于铜和硝酸的反应要特别注意,可以直接加硝酸也可以分步产生:先加非氧化性酸(如盐酸、稀硫酸)后加硝酸盐,铜一样能被溶解


科目:高中化学 来源: 题型:选择题
| A. | 三氟化氮的电子式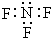 | B. | 水合氢离子电子式: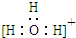 | ||
| C. | 氟离子的结构示意图: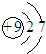 | D. | 中子数为18的硫原子${\;}_{16}^{34}$S |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸干碳酸钾溶液得到的固体物质为KOH | |
| B. | 铁表面镀铜时,铜与电源的负极相连,而铁与电源的正极相连 | |
| C. | 工业合成氨反应温度选择700 K左右,可使催化剂活性最强并提高原料利用率 | |
| D. | CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的△H=2×283.0kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
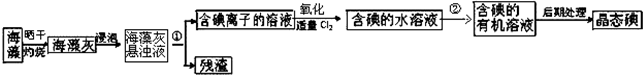
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 同主族元素随原子序数递增,元素原子的得电子能力逐渐增强 | |
| B. | 同主族元素随原子序数递增,单质氧化能力逐渐增强 | |
| C. | 同主族元素原子最外层电子数都相同 | |
| D. | 同主族元素的原子半径,随原子序数增大而逐渐增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气通入等物质的量溴化亚铁溶液中:2Cl2+2Fe2++2 Br-=4 Cl-+2Fe3++Br2 | |
| B. | 向苯酚溶液中滴加Na2CO3溶液: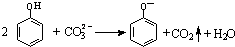 | |
| C. | 足量的CO2通入饱和碳酸钠溶液中:CO2+CO32-+H2O=2HCO3- | |
| D. | 氨水吸收过量的SO2:SO2+2NH3•H2O=SO32-+2NH4++H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com