【答案】
分析:(1)根据c=
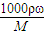
计算质量分数为98%的浓硫酸的物质的量浓度;硫酸的浓度越大,密度越大,据此结合c=
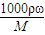
判断49% H
2SO
4的物质的量浓度;
(2)根据稀释定律,稀释前后溶质硫酸的物质的量不变,据此计算需要浓硫酸的体积;
(3)根据配制溶液的实验操作过程进行实验步骤排序;
(4)分析操作对溶质物质的量、溶液体积的影响,根据c=
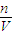
判断对所配溶液浓度的影响.
解答:解:(1)质量分数为98%、密度为1.84g?cm
-3的浓硫酸的物质的量浓度为
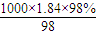
mol/L=18.4mol/L;
令质量分数为49% H
2SO
4的密度为yg/mL,则其物质的量浓度
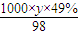
mol/L,硫酸的浓度越大,密度越大,故y<1.84g,故
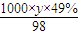
mol/L<9.2mol?L
-1,
故答案为:18.4mol/L;C;
(2)根据稀释定律,稀释前后溶质的物质的量不变,设需要浓硫酸的体积为xmL,所以xmL×18.4mol/L=250mL×1mol/L,解得:x≈13.6,故答案为:13.6mL;
(3)操作步骤有计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作,用量筒量取(用到胶头滴管)18.4mol/L的浓硫酸,在烧杯中稀释,用玻璃棒搅拌,恢复室温后转移到250mL容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀,
故正确的操作顺序为:ADECBHGF,故答案为:ADECBHGF;
(4)A.用量筒量取一定量液体时,仰视液面读数,量取浓硫酸的体积偏大,所配溶液的浓度偏高,故A符合;
B.溶解搅拌时有液体飞溅,硫酸有损失,移入容量瓶内硫酸的物质的量偏小,所配溶液的浓度偏低,故B不符合;
C.定容时俯视容量瓶瓶颈刻度线,液面在刻度线下方,溶液的体积偏小,所配溶液的浓度偏高,故C符合;
D.没有用蒸馏水洗烧杯2-3次,烧杯壁沾有少量的硫酸,移入容量瓶内硫酸的物质的量偏小,所配溶液的浓度偏低,故D不符合;
E.最后需加水定容,容量瓶刚用蒸馏水洗净,没有烘干,对所配溶液的浓度无影响,故E不符合;
F.定容时,滴加蒸馏水,若液面略高于刻度线,溶液的体积偏大,所配溶液的浓度偏低,故F不符合;
G.摇匀后见液面下降,少量溶液残留在瓶塞与瓶口之间,再加水至刻度线,溶液的体积偏大,所配溶液的浓度偏低,故G不符合;
H.容量瓶用蒸馏水洗净后,再用所配溶液润洗,容量瓶内壁沾有少量溶质,所配溶液的浓度偏高,故H符合;
故答案为:ACH.
点评:本题考查了一定物质的量浓度溶液的配制,根据c=
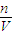
理解配制原理与误差分析,注意浓硫酸的稀释操作.

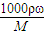 计算质量分数为98%的浓硫酸的物质的量浓度;硫酸的浓度越大,密度越大,据此结合c=
计算质量分数为98%的浓硫酸的物质的量浓度;硫酸的浓度越大,密度越大,据此结合c=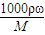 判断49% H2SO4的物质的量浓度;
判断49% H2SO4的物质的量浓度;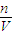 判断对所配溶液浓度的影响.
判断对所配溶液浓度的影响.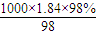 mol/L=18.4mol/L;
mol/L=18.4mol/L;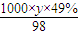 mol/L,硫酸的浓度越大,密度越大,故y<1.84g,故
mol/L,硫酸的浓度越大,密度越大,故y<1.84g,故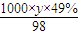 mol/L<9.2mol?L-1,
mol/L<9.2mol?L-1,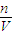 理解配制原理与误差分析,注意浓硫酸的稀释操作.
理解配制原理与误差分析,注意浓硫酸的稀释操作. 

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案