
【题目】归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:归纳正确的是( )
(1)常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,则有c(Na+)+ c(H+)=c(OH-)+ c(CH3COO-)
(2)对已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,生成物的百分含量一定增加
(3)常温下,AgCl在同物质的量浓度的CaCl2和NaCl溶液中的溶解度相同
(4)常温下,已知酯酸电离平衡常数为Ka;醋酸根水解平衡常数为Kh:水的离子积为Kw:则有:Ka·Kh=Kw
(5)电解精炼铜时,电解质溶液中铜离子浓度不变
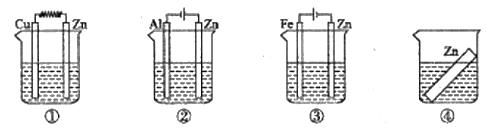
(6)如图装置中都盛有0.1mol/L的NaCl溶液,放置一段时间后,装置中的四块相同的锌片腐蚀速率由大到小的正确顺序是②①④③
A.(1)(4)(6)
B.(1)(2)(4)(6)
C.(2)(4)(5)
D.(2)(3)(4)(6)
【答案】A
【解析】
(1) pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,溶液中的溶质为醋酸钠和醋酸,依据电荷守恒原理可得:c(Na+)+ c(H+)=c(OH-)+ c(CH3COO-),(1)正确;
(2)增大反应物浓度,平衡正向移动,生成物的物质的量增大,但百分含量不一定增大,(2)不正确;
(3)常温下,AgCl在同物质的量浓度的CaCl2和NaCl溶液中的溶解度不相同,在前者中溶解度小,(3)不正确;
(4)常温下,已知醋酸电离平衡常数为Ka=![]() ;醋酸根水解平衡常数为Kh=
;醋酸根水解平衡常数为Kh=![]() ,水的离子积为Kw= c(H+)c(OH-):则有:Ka·Kh=
,水的离子积为Kw= c(H+)c(OH-):则有:Ka·Kh=![]() ×
×![]() = c(H+)c(OH-)=Kw,(4)正确;
= c(H+)c(OH-)=Kw,(4)正确;
(5)电解精炼铜时,阳极Ni、Fe、Cu等失电子,阴极Cu2+得电子,电解质溶液中铜离子浓度减小,(5)不正确;
(6)装置中:①锌为原电池负极,加速腐蚀;②锌为电解池阳极,腐蚀速率比①还快;③锌为电解池阴极,得到保护;④锌为通常情况下的腐蚀。从而得出四块相同的锌片腐蚀速率由大到小的正确顺序是②①④③,(6)正确;
综合以上分析,(1)(4)(6)正确,故选A。


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式不正确的是
A.向铁制器具上电镀铜,阴极的电极反应为:Cu2++2e-=Cu
B.电解饱和食盐水获取烧碱和氯气:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
C.饱和Na2CO3溶液与CaSO4固体反应:CO32-(aq)+CaSO4(s)![]() CaCO3(s)+SO42-(aq)
CaCO3(s)+SO42-(aq)
D.向氢氧化钡溶液中加入稀硫酸:Ba2++OH-+H++SO42- =BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知还原性:![]() ,某溶液中含如下离子组中的几种
,某溶液中含如下离子组中的几种![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,某同学欲探究该溶液的组成进行了如下实验:
,某同学欲探究该溶液的组成进行了如下实验:
①用铂丝醮取少量溶液,在火焰上灼烧,透过蓝色钴玻璃,观察到紫色火焰;
②另取原溶液加入足量盐酸有无色气体生成,该气体遇空气变成红棕色,此时溶液颜色加深,但无沉淀生成;
③取②反应后溶液置于试管中加入![]() ,充分振荡静置后溶液分层,下层为无色。
,充分振荡静置后溶液分层,下层为无色。
下列说法正确的是( )
A.②中无色气体是![]() 气体,可能含有
气体,可能含有![]() 气体
气体
B.原溶液中![]() 与
与![]() 只存在一种离子
只存在一种离子
C.原溶液中![]() 与
与![]() 至少存在一种离子
至少存在一种离子
D.为确定是否含有![]() 可取原溶液加入过量硝酸银溶液,观察是否产生白色沉淀
可取原溶液加入过量硝酸银溶液,观察是否产生白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于![]() 水解的说法错误的是( )
水解的说法错误的是( )
A.在稀溶液中,水解达到平衡时,无论加![]() 饱和溶液还是加水稀释,平衡均向右移动
饱和溶液还是加水稀释,平衡均向右移动
B.浓度为![]() 和
和![]() 的两种
的两种![]() 溶液,其他条件相同时,
溶液,其他条件相同时,![]() 的水解程度前者小于后者
的水解程度前者小于后者
C.其他条件相同时,同浓度的![]() 溶液在50 ℃和20 ℃时发生水解,50 ℃时
溶液在50 ℃和20 ℃时发生水解,50 ℃时![]() 的水解程度比20 ℃时的小
的水解程度比20 ℃时的小
D.为抑制![]() 的水解,更好地保存
的水解,更好地保存![]() 溶液,应加少量盐酸
溶液,应加少量盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中发生如下反应:X(g)+3Y(g)![]() 2Z(g),△H<0。如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量,下列说法中正确的是( )
2Z(g),△H<0。如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量,下列说法中正确的是( )
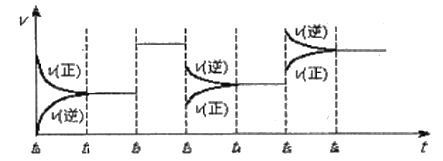
A.t3时降低了温度
B.t2-t3时间段相对于t1-t2时间段来说平衡并没有移动
C.t5时增大了压强
D.t4-t5时间内反应物的转化率最低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素Q、X、Y、Z的原子序数逐渐增大,Q的单质是空气的主要成分之一,X与Q同周期,且X是该周期中非金属性最强的元素,Y、Z原子的最外层电子数之和为10,Y与Z形成的某种阴离子的结构如图所示.下列说法正确的是
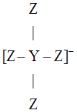
A.X、Z的简单氢化物的水溶液均为强酸
B.Y的单质在常温下性质稳定,不与强酸、强碱反应
C.Y与Z形成的化合物可用作高温结构陶瓷材料
D.简单氢化物的稳定性:Q<X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有100mLMgCl2和AlCl3的混合溶液其中c(Mg2+)=2molL-1,c(Cl-)=7molL-1,要使镁离子转化成Mg(OH)2并使Mg2+和Al3+分离开来,至少需要4molL-1的NaOH溶液
A.140 mL B.120 mL C.200 mL D.80 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,某反应达到了化学平衡,其反应过程对应的能量变化如图。下列说法正确的是
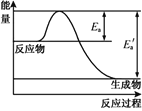
A.Ea为逆反应活化能,E为正反应活化能
B.该反应为放热反应,ΔH=Ea’-Ea
C.所有活化分子的平均能量高于或等于所有分子的平均能量
D.温度升高,逆反应速率加快幅度大于正反应加快幅度,使平衡逆移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中装置通过控制开关连接K1或K2,可利用太阳能电池电解水制高纯氢。下列说法错误的是( )
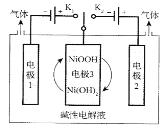
A.制H2时,连接K1
B.制O2时,电极3的反应式:NiOOH+H2O+e-=Ni(OH)2+OH-
C.交替连接K1和K2,可使电极3得以循环使用
D.上述过程,若用酸性电解质一样可以实现上述过程
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com